LA PÉRITONITE INFECTIEUSE FÉLINE (PIF)
Points clés
Le coronavirus félin (FCoV) est un virus omniprésent chez les chats domestiques et de grande taille.
La plupart des chats infectés par le FCoV restent en bonne santé ou ne présentent qu'une légère entérite.
Seule une petite proportion de chats infectés par le FCoV développe une péritonite infectieuse féline (PIF).
La transmission du FCoV est féco-orale via des bacs à litière et des fomites.
L'infection par le FCoV des monocytes est l'événement clé de la pathogenèse de la PIF.
Très probablement, les mutations internes du FCoV (vers des mutants avec un changement de tropisme cellulaire survenant chez un chat individuel) sont à l'origine du développement du FCoV hautement pathogène induisant la PIF (théorie de la mutation interne).
Les génomes coronaviraux possèdent un niveau élevé de variation génétique en raison du taux d'erreur de l'ARN polymérase conduisant à différents types de mutations.
La PIF affecte de manière disproportionnée les chats de race de moins de deux ans.
Le prélèvement de l'épanchement, lorsqu'il est présent, est l'étape diagnostique la plus utile.
Le diagnostic définitif de la PIF repose sur des changements histopathologiques cohérents dans les tissus affectés et cela, avec l'immunomarquage de l'antigène FCoV, est considéré comme l'étalon-or pour le diagnostic.
La RT-PCR fécale n'est pas utile pour le diagnostic de la PIF mais pour l'identification des excréteurs de FCoV au sein d'une colonie de chats.
Un test d'anticorps FCoV positif n'est pas une confirmation de la PIF (ce n'est pas un "test FIP") mais l'absence d'anticorps FCoV rend la PIF moins probable.
Sans traitement avec de nouveaux médicaments anti-coronaviraux potentiellement curatifs (pas encore largement disponibles), la PIF a un très mauvais pronostic.
L'ABCD considère que le vaccin FIP n'est pas essentiel et il n'est pas recommandé chez les chats positifs aux anticorps FCoV. Cependant, les chatons FCoV négatifs pour les anticorps pourraient potentiellement bénéficier de la vaccination.
Propriétés des agents
Classement des virus
Certains aspects clés des propriétés du virus sont présentés dans les figures 1 et 2. Le coronavirus félin (FCoV) est une grande particule virale sphérique enveloppée et est classé dans l'ordre des Nidovirales ; famille des Coronaviridae ; genre Alphacoronavirus; espèce Alphacoronavirus 1 , qui comprend également le coronavirus canin (CCoV), le virus de la gastro-entérite transmissible (TGEV) et le coronavirus respiratoire porcin (PRCoV) (De Groot et al., 2012). Le nouveau coronavirus du syndrome respiratoire aigu sévère 2 (SARS-CoV-2) est très distinct et différent du FCoV, appartenant à un genre différent ; Le SARS-CoV-2 fait partie du genre Betacoronavirus (Haake et al., 2020) et des directives distinctes sur le SRAS-CoV-2 chez les chats ont été publiées (Hosie et al., 2021) ainsi que des informations mises à jour disponibles dans la directive ABCD sur « le SRAS-CoV-2 et les chats » disponibles ici .
Génome et structure du virus
Étant un virus enveloppé, le FCoV est facilement inactivé par la plupart des désinfectants, la vapeur et le lavage à 60°C. Il a été suggéré qu'il conserve son infectivité pendant des jours à quelques semaines, selon les conditions environnementales (Scott, 1988).
Les deux tiers 5' du génome du coronavirus sens positif (CoV) sont constitués de deux cadres de lecture ouverts qui se chevauchent (ORF 1a et 1b) qui codent pour la polyprotéine non structurelle (pp) 1 (pp1a et pp1b) (Fig. 1). Les polyprotéines sont clivées en protéines non structurelles individuelles (nsps), y compris l'ARN polymérase dépendante de l'ARN, qui joue un rôle dans la réplication virale. L'ORF 1a code également pour les protéases virales, y compris la protéase virale de type 3C qui est une cible potentielle pour la thérapie antivirale (voir la section sur le traitement). L'autre tiers du génome est constitué d'ORF codant pour les protéines structurelles, la pointe [S], la matrice [M], la nucléocapside [N] et l'enveloppe [E] (Fig. 2) et certaines protéines accessoires non structurelles 3a, 3b, 3c, 7a et 7b (Fig. 1) (Terada et al., 2014). Les protéines non structurales sont impliquées dans la réplication du virus.
Les souches de FCoV de type II résultent d'une recombinaison avec le CCoV (Fig. 3), comprenant généralement le pic de CCoV et des quantités variables de gènes ORF 3 adjacents (Herrewegh et al., 1998 ; Le Poder et al., 2013 ; Terada et al., 2014). L'ARN polymérase ARN-dépendante crée une copie d'ARN à brin négatif pleine longueur du génome ainsi qu'un ensemble imbriqué d'ARN sous-génomiques (ARN) plus petits avec une extrémité 3 'commune. Ces ARN à brin négatif servent de matrices pour de nouveaux génomes de sens positif et des ARNm sous-génomiques de sens positif. Les ARNm sous-génomiques ont une structure imbriquée avec des séquences commençant à l'extrémité 3' et s'étendant à diverses distances vers l'extrémité 5'. Si un test de transcriptase inverse (RT)-PCR en temps réel est conçu pour amplifier les ARNm sous-génomiques en 3', cela peut influencer les résultats quantitatifs de la charge FCoV apparente (voir la section transcriptase inverse (RT)-PCR dans le diagnostic). En général, seul l'ORF le plus en 5' de chaque ARNm sous-génomique est utilisé pour coder les protéines même si les ARNm sous-génomiques ont plus d'une séquence codante (à l'exception de la plus petite).
Mutations du génome du FCoV
Les génomes coronaviraux possèdent un niveau élevé de variation génétique en raison du taux d'erreur de l'ARN polymérase conduisant à différents types de mutations, notamment des insertions, des délétions et l'introduction de codons d'arrêt ainsi que des recombinaisons. L'hypothèse est que la variation génétique et la sélection ultérieure facilitent également la commutation du tropisme cellulaire chez un chat infecté par le FCoV qui développe une péritonite infectieuse féline (PIF).
Les FCoV sont attribués à deux pathotypes ou biotypes généralement appelés coronavirus entérique félin (FECV), qui se réplique principalement dans l'épithélium entérique, et virus de la péritonite infectieuse féline (FIPV), qui entraîne une infection principalement mortelle avec une réplication efficace dans les monocytes ou les macrophages. (Barker et Tasker, 2020b). Comme il est connu que tous les FCoV peuvent être trouvés et se répliquer de manière systémique (Meli et al., 2004 ; Kipar et al., 2006 ; Fish et al., 2018) (même chez les chats sans PIF), nous préférons appeler les deux biotypes « FCoV » mais en les distinguant comme un « FCoV moins virulent » et un « FCoV associé à la FIP ». Par conséquent, ces termes seront utilisés lorsque cela est possible dans cette ligne directrice pour souligner les différences réelles de comportement biologique entre les FCoV.
Bien que les gènes impliqués dans le changement de virulence du FCoV soient encore inconnus, des mutations dans différents gènes ont été postulées comme étant associées au passage du FCoV moins virulent au FCoV virulent associé à la FIP, y compris le gène de pointe et les gènes accessoires 3c et 7b ( Pedersen et al., 2012) (voir Fig. 2). Les protéines de pointe sont le principal déterminant de l'entrée dans les cellules hôtes (Belouzard et al., 2012), car elles possèdent à la fois des fonctions de liaison aux récepteurs et de fusion (Millet et Whittaker, 2015 ). Deux différences alternatives d'acides aminés dans le peptide de fusion putatif de la protéine S (appelées M1058L et S1060A - nomenclature basée sur la position et la nature du changement d'acide aminé, c'est-à-dire la méthionine en leucine en position 1058 et la sérine en alanine en position 1060) ont été détectées ensemble distingué le FCoV associé à la PIF du FCoV moins virulent en 95.
Une autre mutation a été détectée dans le site de clivage entre la liaison au récepteur (S1) et le domaine de fusion (S2) de la protéine de pointe. Alors que tous les FCoV moins virulents avaient un site de clivage de la furine conservé, dans la plupart des FCoV associés à la PIF, au moins une substitution a été trouvée (Licitra et al., 2013). Des mutations dans la région heptad repeat 1 du gène S seraient également associées à la PIF (Bank-Wolf et al., 2014 ; Lewis et al., 2015).
Le gène ORF 3 code pour une protéine dont la fonction est encore inconnue. Fait intéressant, des mutations conduisant à une protéine tronquée ont été détectées dans environ les deux tiers des gènes 3c du FCoV trouvés chez les chats atteints de PIF (Pedersen et al., 2009 ; Chang et al., 2010 ; Hsieh et al., 2013), tandis que le gène ORF 3 était intact dans tous les FCoV des échantillons fécaux. Cela suggère qu'un 3c intact est une exigence absolue pour l'infection des cellules épithéliales intestinales (Chang et al., 2010; Pedersen et al., 2012), mais n'est pas nécessaire pour la réplication dans les monocytes. Le FCoV associé à la PIF avec un 3c intact se répliquera dans l'intestin mais ce virus ne semble pas être transmis à d'autres chats (Pedersen et al., 2012).
Il existe un consensus général sur le fait que le FCoV le moins virulent se convertit en FCoV associé à la PIF chez le chat individuel par des modifications qui incluent un changement de tropisme cellulaire des entérocytes aux monocytes/macrophages (Pedersen et al., 2009 ; Chang et al., 2012 ; Barker et al., 2013). Cette théorie dite de la mutation interne est étayée par plusieurs études montrant une relation génétique étroite entre le FCoV associé à la PIF et le FCoV provenant d'échantillons fécaux de chats vivant dans le même environnement (Decaro et al., 2021), représentant une relation beaucoup plus étroite que au FCoV collectés sur des chats d'autres environnements. La théorie de la mutation interne a été remise en question à un moment donné sur la base des résultats d'une seule étude qui indiquait que le «FECV» et le «FIPV» étaient deux types distincts de FCoV circulant indépendamment dans la population (Brown et al., 2009). Cependant, dans cette étude, les échantillons ont été dérivés d'une population de chats de refuge, une population dans laquelle l'introduction de différents FCoV génétiquement non apparentés peut être attendue en raison de leur origine géographique différente (Pedersen, 2014). La théorie de la mutation interne est maintenant largement acceptée parmi les chercheurs.
En plus de distinguer les deux pathotypes, le FCoV moins virulent et le FCoV associé à la FIP, il existe une autre classification basée sur les différences de propriétés antigéniques et génomiques dans le FCoV de type I et de type II. Les FCoV de type I et de type II peuvent se présenter sous forme de FCoV moins virulent et de FCoV associé à la PIF (Pedersen, 2014). Le FCoV de type I est le plus répandu dans le monde (Addie et al., 2003 ; Lin et al., 2009 ; Soma et al., 2013 ; Terada et al., 2014 ; Wang et al., 2014 ; Decaro et al., 2021) . Le FCoV de type II résulte d'une double recombinaison entre le FCoV de type I et le CCoV (Herrewegh et al., 1998 ; Terada et al., 2014) dans la cellule féline, ce qui permet l'entrée à la fois du FCoV et du CCoV (Tusell et al., 2007 ; Terada et al., 2014). Des événements de recombinaison se sont produits de nombreuses fois à travers le monde, avec des FCoV individuels de type II contenant des gènes de pointe CCoV et des quantités variables de 3abc, et des gènes d'enveloppe, mais pas le gène de la nucléocapside, qui reste d'origine FCoV (Herrewegh et al., 1998 ; Terada et al., 2014) (voir Fig. 3 ). La plupart des recherches se sont concentrées sur les souches FCoV de type II car, contrairement au FCoV de type I, elles peuvent être facilement propagéesin vitro (Pedersen et al., 1984), facilitant les études expérimentales, bien que la plupart des infections de terrain soient de type I FCoV. Des études expérimentales ont tenté de développer des méthodes de culture pour les FCoV de type 1 en utilisant à la fois des cultures permanentes de cellules épithéliales intestinales félines d'origine iléocytaire et colonocytaire (Desmarets et al., 2013) et des préparations d'organoïdes coliques (Tekes et al., 2020), mais aucune n'est actuellement systématiquement disponible pour utilisation.
Épidémiologie
Transmission du FCoV
Le FCoV est un virus contagieux, et la transmission est souvent indirecte, comme le contact avec des objets (par exemple via des bacs à litière, des pelles, des brosses, des aspirateurs, des chaussures, des mains et des vêtements), la manipulation lors d'expositions félines, de refuges ou dans un cabinet vétérinaire. Les fèces sont la principale source de FCoV, les bacs à litière représentant la principale source d'infection dans les groupes de chats. Les chats sont plus susceptibles d'être infectés par voie orale après un contact avec le FCoV dans les fèces. Ainsi, la principale voie de transmission est féco-orale.
Un rapport de cas (Andre et al., 2020), documentant la rhinite associée à la PIF, a suggéré que les voies respiratoires pourraient être un point d'entrée pour la transmission du FCoV, mais des études supplémentaires sont nécessaires. Étant donné que le virus ne se trouve que rarement dans la salive des chats en bonne santé, un contact étroit ou le partage de bols d'alimentation ne sont pas les principales voies d'infection (Addie et Jarrett, 2001). La transmission transplacentaire a été décrite à partir d'une reine qui a développé une PIF pendant la grossesse (Pastoret et Henroteaux, 1978), mais ce phénomène est extrêmement rare (Addie et Jarrett, 1990). Une étude (Stranieri et al., 2020a) a évalué le tissu testiculaire et le sperme de chats mats pour le FCoV par RT-PCR afin d'évaluer le risque de transmission vénérienne du FCoV. L'ARN du FCoV a été amplifié à partir d'environ 15 % (6 sur 39) des testicules de l'étude et aucun des 17 échantillons de sperme testés, suggérant que la transmission vénérienne était peu probable. La transmission du FCoV par transfusion sanguine n'a pas été rapportée.
Dans les chatteries d'élevage infectées par le FCoV, les chatons sont généralement infectés à un jeune âge en quelques semaines (Lutz et al., 2002) (voir aussi « Pathogenèse et immunité »).
Après une infection naturelle, les chats commencent à excréter le virus dans les fèces en une semaine (Meli et al., 2004) et continuent à excréter pendant des semaines, des mois et même quelques mois à vie (persistant) (Addie et Jarrett, 2001 ; Addie et al., 2003 ; Pedersen et al., 2008). La mue est généralement intermittente et récurrente (bien que quelques chats semblent récupérer et ne muent plus après une période initiale de mue), mais certains chats ont une mue persistante (Addie et al., 2003 ; Pedersen et al., 2008), qui peut être influencée par la dose de virus reçue lors de l'inoculation (Vogel et al., 2010). L'excrétion fécale atteint des niveaux élevés (Addie et Jarrett, 2001 ; Addie et al., 2003 ; Pedersen et al., 2008 ; Vogel et al., 2010). Plus le titre d'anticorps contre le FCoV est élevé, plus le chat risque d'excréter le FCoV (Addie et Jarrett, 2001 ; Lutz et al., 2002 ; Pedersen et al., 2008 ; Addie et al., 2015 ; Felten et al., 2020), ainsi que plus la fréquence d'excrétion fécale de FCoV et la charge de FCoV présente sont élevées (Felten et al., 2020). En raison de la courte durée présumée de toute immunité après l'infection, le fait de ne pas séparer les chats non excréteurs des excréteurs de virus pourrait favoriser la propagation et la persistance du FCoV dans un ménage, ce qui pourrait expliquer la prévalence élevée d'anticorps dans l'environnement multi-chats.
La transmission horizontale de la PIF, contrairement au FCoV, ne semble pas se produire très fréquemment, voire pas du tout (voir les sections Pathogenèse et immunité, et Gestion de la maladie).
Bien que le FCoV et le CCoV soient étroitement liés, le contact avec les chiens ne semble pas être un facteur prédisposant majeur à l'infection par le CoV des chats (Le Poder et al., 2013). Cependant, Benetka et al. (2006) ont trouvé des virus recombinants CoV félins/canins chez les chats d'un refuge de sauvetage qui abritait à la fois des chats et des chiens. Dans le gène de la protéine M, ces souches étaient plus étroitement liées au CCoV de type FCoV qu'au FCoV, ce qui suggère qu'une infection par le CCoV et des recombinaisons ultérieures avec le FCoV se sont produites dans cet environnement.
Prévalence du FCoV
À l'exception de quelques îles de populations félines isolées (par exemple les îles Falkland) (Horzinek et Osterhaus, 1979 ; Levy et al., 2008 ; Addie et al., 2012), une infection au FCoV a été signalée dans le monde entier. Le FCoV, et donc la PIF, est particulièrement courant lorsque les conditions sont surpeuplées (Sharif et al., 2009 ; Felten et al., 2020), tandis que la prévalence est plus faible chez les chats hébergés individuellement, errants ou sauvages (Addie et Jarrett, 1992 ; Herrewegh et al., 1995 ; Addie, 2000 ; Bell et al., 2006 ; Cave et al., 2004, Taharaguchi et al., 2012). Les félidés sauvages, en particulier ceux des zoos, peuvent également être infectés par le FCoV (Kennedy et al., 2002). Les guépards infectés par le FCoV sont même prédisposés à développer la PIF (Evermann et al., 1988).
Le FCoV est très contagieux, et dans les foyers où il est présent, la prévalence des anticorps indiquant une exposition est souvent proche de 100 % (Felten et al., 2020). Les chats qui ont passé plus de 60 jours dans des refuges au Royaume-Uni étaient cinq fois plus susceptibles d'avoir des anticorps (Cave et al., 2004).
Dans une étude japonaise portant sur 17 392 chats, la prévalence des anticorps était de 66,7 % chez les chats de race et de 31,2 % chez les chats domestiques (Taharaguchi et al., 2012). La prévalence a considérablement augmenté chez les races pures à l'âge de trois mois, alors qu'elle n'a pas beaucoup fluctué chez les races sans pedigree avec le vieillissement, ce qui indique que les environnements de chatterie peuvent contribuer aux épidémies de FCoV. Les chats de race pure des régions du nord du Japon étaient généralement positifs pour les anticorps (76,6% à Hokkaido, 80,0% à Tohoku), ce qui indique que les chats de chatterie dans les climats froids pourraient être plus étroitement confinés. Parmi les chats de race pure au Japon, les races American shorthair, himalayen, oriental, persan et siamois ont montré une faible prévalence d'anticorps, tandis que les races American curl, Maine coon, chat des forêts norvégiennes, Ragdoll et Scottish fold avaient une prévalence d'anticorps élevée (Taharaguchi et al. , 2012).
Prévalence et facteurs de risque de PIF
La prévalence de la PIF au sein d'une population de chats dans son ensemble était de 0,52 % (60 sur 11 535) de tous les chats examinés au North Carolina State University College of Veterinary Medicine (1986 - 2002), ce qui est élevé compte tenu du fait que l'enseignement universitaire américain les hôpitaux sont des centres de référence tertiaires (Pesteanu-Somogyi et al., 2006). Dans les environnements multi-chats, comme chez les éleveurs et les refuges, jusqu'à 12 % des chats infectés par le FCoV peuvent succomber à la PIF (Addie et al., 1995). L'incidence de la PIF dans un ménage ou une chatterie augmente avec le nombre de chats (Kass et Dent, 1995).
Alors que les chats de tout âge ou de toute race peuvent développer la PIF, la PIF affecte de manière disproportionnée les chats de race de moins de deux ans (Rohrbach et al., 2001 ; Norris et al., 2005 ; Pesteanu-Somogyi et al., 2006 ; Tsai et al., 2011 ; Worthing et al., 2012 ; Soma et al., 2013 ; Riemer et al., 2016). En Australie, 71 % des chats atteints de PIF étaient de race pure et 55 % avaient moins de deux ans (Norris et al., 2005). Dans une étude de Caroline du Nord, 67 % des chats atteints de PIF avaient moins de deux ans, et les chats de race étaient également surreprésentés : la PIF était présente chez près de 1,3 % des chats de race contre 0,35 % chez les chats de race mixte, et la prédisposition de la race était statistiquement significative dans les races Abyssin Bengal, Birman, Himalayan, Ragdoll et Rex (Pesteanu-Somogyi et al., 2006). Dans une étude en Australie, croisement domestique,
Le pourcentage d'épanchements positifs par FCoV reverse-transcriptase (RT)-PCR variait selon la race et l'âge du chat dans une étude au Japon (Soma et al., 2013). Dans cette étude, la RT-PCR a été utilisée sur les épanchements pour indiquer la PIF, bien que le diagnostic n'ait pas été confirmé. Chez les chats jusqu'à un an, 95 % des épanchements de chats de race étaient positifs à la RT-PCR, alors que l'ARN du FCoV n'a été trouvé que dans 79 % des épanchements de chats domestiques, et jusqu'à l'âge de cinq ans, les épanchements de chats de race étaient plus susceptibles d'être FCoV RT-PCR-positifs que ceux des chats domestiques.
Certains auteurs ont noté une prédisposition à la PIF chez les chats mâles plutôt que femelles (Rohrbach et al., 2001 ; Benetka et al., 2004 ; Norris et al., 2005 ; Worthing et al., 2012 ; Riemer et al., 2016), tandis que d'autres n'ont trouvé aucune prédisposition sexuelle (Pedersen, 1976). Les pedigrees des chats qui meurent de la PIF remontent souvent au chat reproducteur plutôt qu'à la reine (Foley et Pedersen, 1996).
Pathogénèse
Comme indiqué ci-dessus, la principale voie d'infection par le FCoV est fécale-orale. Suite à l'ingestion du virus, par exemple en toilettant des pattes contaminées lors de l'utilisation d'un bac à litière ou en mangeant des aliments contaminés par des fomites, le virus pénètre et se réplique d'abord dans les cellules épithéliales des villosités de l'intestin grêle. Le FCoV de type II utilise le récepteur félin aminopeptidase-N (fAPN) présent sur les villosités intestinales et le monocyte (Tusell et al., 2007 ; Tekes et al., 2010). Le récepteur du FCoV de type I reste inconnu (Dye et al., 2007 ; Tekes et al., 2010).
L'excrétion du FCoV se produit dans les fèces deux à trois jours après l'infection (Meli et al., 2004 ; Kipar et al., 2010). Cette infection n'est généralement pas associée à des signes cliniques, mais s'accompagne parfois d'une entérite (Sabshin et al., 2012). Parfois, des entérites à coronavirus très graves, voire mortelles, ont été signalées (Kipar et al., 1998). Comme décrit précédemment, l'excrétion du virus du FCoV de type I dans les fèces suit deux schémas. (1) La plupart des chats infectés de manière transitoire excrètent le virus pendant deux à trois mois (Addie et Jarrett, 2001) - l'immunité est de courte durée car ces chats peuvent être réinfectés par la même souche ou une autre souche de FCoV, en quelques semaines ( Addie et al., 2003), montrant des infections récurrentes. (2) Environ 13 % des chats infectés par le FCoV de type I deviennent des chats porteurs infectés de manière persistante. Cependant, en revanche, les chats infectés expérimentalement par le FCoV de type II excrètent le virus pendant environ deux semaines (Stoddart et al., 1988) et aucun chat porteur n'a été signalé. Seule une petite proportion de chats infectés par le FCoV développe ensuite la PIF (Pedersen, 1987 ; Kipar et al., 2005).
Dès deux semaines après l'infection, le virus est retrouvé dans le côlon (Kipar et al., 2010). Chez les chats porteurs asymptomatiques infectés de manière persistante, la jonction iléo-cœcolique est le principal site de réplication virale (Herrewegh et al., 1997).
Les ganglions lymphatiques mésentériques (MLN), en tant que premier site le plus probable de propagation du FCoV à partir de l'intestin, quelle que soit la virémie ultérieure, ont été évalués pour les médiateurs de la réponse immunitaire innée, et des preuves de l'implication des récepteurs de type péage ont été trouvées dans la réponse au FCoV (Malbon et al., 2019).
La réplication efficace du FCoV dans les monocytes et les macrophages activés est un événement clé dans la pathogenèse de la PIF (Malbon et al., 2020a) : le chat continuera-t-il ou non à développer une réponse immunitaire réussie et à éliminer le virus ; si le chat développera une réponse immunitaire semi-réussie, restant cliniquement en bonne santé, mais excrétant le FCoV dans les fèces pendant des mois ou des années ; ou si le chat développera une réponse immunitaire délétère, entraînant une vascularite pyogranulomateuse généralisée et finalement une mort prématurée sans traitement antiviral efficace. Le résultat de l'infection des monocytes et des macrophages dépend en partie de la cellule ; cependant, les souches virulentes se répliquent plus efficacement dans les monocytes et les macrophages permissifs (Dewerchin et al., 2005). Les monocytes d'une population non consanguine de chats variaient dans leur capacité à maintenir la réplication du FCoV, que la souche de FCoV soit jugée très virulente ou relativement avirulente, les monocytes de certains chats ne soutenant pas la réplication du FCoV associé à la FIP ou moins virulent non- FCoV associé à la PIF (Dewerchin et al., 2005). Ce qui se passe dans les monocytes et les macrophages à la suite d'une infection par le FCoV est assez extraordinaire : généralement, une cellule infectée affichera des antigènes viraux en association avec l'antigène leucocytaire félin (la version féline du complexe majeur d'histocompatibilité) à sa surface pour activer la médiation par les anticorps ou les cellules. , lyse; mais chez les chats atteints de PIF, les macrophages infectés manquaient d'expression de surface des antigènes viraux (Cornelissen et al., 2007).
La virémie FCoV, lorsqu'elle survient, est de courte durée, culminant environ sept à 14 jours après l'infection et diminuant par la suite (Kipar et al., 2010 ; Mustaffa-Kamal et al., 2019), donc au moment des signes cliniques de PIF apparaissent, la virémie sera probablement terminée, de sorte que la réalisation d'une RT-PCR sur des échantillons de sang pour détecter l'ARN du FCoV est souvent négative chez les chats atteints de PIF.
La virulence du virus, la charge virale et la réponse immunitaire du chat déterminent si la PIF se développera ou non. Ainsi, la génétique virale et l'immunité de l'hôte sont susceptibles de jouer un rôle dans le développement de la PIF (Addie et Jarrett, 1995 ; Dewerchin et al., 2005 ; Rottier et al., 2005 ; Hsieh et Chueh, 2014 ; Pedersen et al. , 2014 ; Mustaffa-Kamal et al., 2019 ; Malbon et al., 2020b). La résistance en termes de capacité à combattre l'infection par le FCoV augmente entre six et 12 mois (Pedersen et al., 2014).
Chez les chats chez lesquels le FCoV est capable de se répliquer librement dans les monocytes, les monocytes infectés se fixent aux parois des veines de petite et moyenne taille, libérant la métalloprotéinase matricielle-9 (MMP-9) qui détruit le collagène de la lame basale des vaisseaux affectés. Cet événement permet l'extravasation des monocytes, où ils se différencient en macrophages, et permet au plasma de s'échapper des vaisseaux (Kipar et al., 2005). On pense que la mort des macrophages chargés de virus (apoptose) joue un rôle clé dans la dissémination du FCoV (Watanabe et al., 2018). Dans les formes plus aiguës de PIF, de nombreux vaisseaux sanguins sont touchés et cette fuite se manifeste cliniquement par un épanchement. Dans les formes plus chroniques de PIF, moins de vaisseaux sanguins sont touchés, mais les pyogranulomes périvasculaires peuvent devenir assez volumineux, voire faciles à confondre avec une tumeur à l'examen macroscopique, lors d'une laparotomie exploratrice ou d'une nécropsie. Les macrophages infectés par le FCoV libèrent des cytokines telles que le facteur de nécrose tumorale alpha (TNF-alpha) (Takano et al., 2007a) : le TNF-alpha régule positivement le fAPN (Takano et al., 2007a), provoque une lymphopénie (Takano et al., 2007b ) et inhibe l'apoptose des neutrophiles (Takano et al., 2009). Le rôle du TNF-alpha est important dans le développement de la PIF, de sorte que des anticorps anti-TNF-alpha ont été utilisés comme thérapie possible (Doki et al., 2013 ; Doki et al., 2020b).
Comme décrit ci-dessus, la PIF survient chez un petit pourcentage de chats infectés par le FCoV in vivo, suite à une infection par le FCoV, et la transmission horizontale de la PIF, via une souche de FCoV associée à la FIP, ne semble pas se produire très fréquemment, voire pas du tout. Plusieurs observations expérimentales et de terrain appuient l'hypothèse selon laquelle les chats ne sont pas infectés par le FCoV associé à la FIP par la voie naturelle. Premièrement, les souches de FCoV associées à la FIP provenant de différents chats d'un même foyer présentent pour la plupart des caractéristiques génétiques uniques suggérant que ces virus se sont développés indépendamment chez les chats individuels (Chang et al., 2012 ; Licitra et al., 2013, Barker et al., 2013) . Seul un très faible pourcentage de chats atteints de PIF peuvent excréter le FCoV associé à la PIF, probablement parce que ces virus mutés ne peuvent pas se répliquer dans les entérocytes (Pedersen et al., 2009 ; Pedersen et al., 2012 ; Wang et al., 2013 ; Porter et al., 2014). Par ailleurs, les échantillons fécaux de chats atteints de PIF ne provoquent pas de maladie après inoculation orale (Pedersen et al., 2012). De plus, dans les ménages multi-chats, les cas de PIF sont souvent limités à un seul chat (ou à quelques-uns) et des cas supplémentaires peuvent ne pas se produire avant plusieurs années. Cependant, quelques cas ont été rapportés dans lesquels un nombre plus élevé de chats (> 10 %) ont développé une PIF dans des environnements multi-chats (Graham et al., 2012 ; Wang et al., 2013 ; Barker et al., 2013). Dans ces soi-disant mini-épidémies, d'autres facteurs que la transmission horizontale directe jouent probablement un rôle (voir le chapitre « Contrôle du FCoV et de la PIF dans des situations spécifiques ») quelques cas ont été rapportés dans lesquels un nombre plus élevé de chats (> 10 %) ont développé une PIF dans des environnements multi-chats (Graham et al., 2012 ; Wang et al., 2013 ; Barker et al., 2013). Dans ces soi-disant mini-épidémies, d'autres facteurs que la transmission horizontale directe jouent probablement un rôle (voir le chapitre « Contrôle du FCoV et de la PIF dans des situations spécifiques ») quelques cas ont été rapportés dans lesquels un nombre plus élevé de chats (> 10 %) ont développé une PIF dans des environnements multi-chats (Graham et al., 2012 ; Wang et al., 2013 ; Barker et al., 2013). Dans ces soi-disant mini-épidémies, d'autres facteurs que la transmission horizontale directe jouent probablement un rôle (voir le chapitre « Contrôle du FCoV et de la PIF dans des situations spécifiques »)
Immunité
La PIF est associée à une suppression sévère des cellules tueuses naturelles et des cellules T régulatrices, des acteurs centraux de l'immunité innée et adaptative à médiation cellulaire (CMI), respectivement (Vermeulen et al., 2013). Jusqu'à l'étude sur la réplication du FCoV dans les monocytes par Dewerchin et al. (2005), l'issue de l'infection au FCoV avait été principalement attribuée aux facteurs de virulence (mutations, délétions) du virus (Pedersen, 2014), bien que les facteurs de l'hôte jouent évidemment un rôle dans la pathogenèse. L'interféron gamma (IFN-γ), qui est un modulateur important du CMI, est l'une des cytokines les plus étudiées et importantes dans l'infection par le FCoV. L'expression de l'ARNm de l'IFN-γ par les leucocytes dans la circulation ou dans les tissus a été étudiée dans de nombreuses études utilisant la RT-PCR et l'immunohistochimie (Gunn-Moore et al., 1998 ; Dean et al., 2003 ; Kiss et al., 2004 Berg et al., 2005 ; Gelain et al., 2006). Certaines études (Gunn-Moore et al., 1998 ; Kiss et al., 2004 ; Gelain et al., 2006) ont trouvé une expression élevée d'ARNm d'IFN-γ dans les leucocytes du sang périphérique de chats cliniquement normaux infectés par le FCoV, mais une faible expression dans chats atteints de PIF. En revanche, l'ARNm de l'IFN-γ est abondant dans les lésions de PIF (Berg et al., 2005). Giordano et Paltrinieri (2009) ont conclu dans leur article que bien que les chats résistants à la PIF aient une forte CMI, qui peut être mesurée par une production élevée d'IFN-γ sérique, la CMI est également susceptible d'être impliquée dans la pathogenèse de la PIF, bien qu'au niveau tissulaire. , comme en témoigne la concentration élevée en IFN-γ des épanchements de FIP. Ces résultats pourraient servir de base à d'autres études sur les mécanismes par lesquels la production d'IFN-γ pourrait empêcher l'apparition de la PIF. L'importance du CMI dans la résistance à la PIF a été étudiée plus en détail dans une étude expérimentale (Mustaffa-Kamal et al., 2019) dans laquelle les réponses antivirales des lymphocytes T ont été mesurées lors d'une exposition primaire et secondaire au FCoV associé à la FIP. Les réponses adaptatives définitives des lymphocytes T prédictives de l'issue de la maladie n'ont pas été détectées au cours de la phase précoce de l'infection primaire par le FCoV associé à la PIF, mais des réponses de cellules T antivirales de récupération ont été observées plus tard dans l'infection primaire pour un sous-ensemble de chats présentant une progression lente vers la PIF ou une résistance à la PIF par rapport à ceux montrant une progression rapide vers la PIF.
Hsieh et Chueh (2014) ont cherché à savoir si les polymorphismes mononucléotidiques (SNP) du gène IFN-γ félin (fIFNG) étaient associés à l'issue de l'infection au FCoV. Certains allèles «résistants à la FIP» et «sensibles à la FIP» ont été suggérés, et une étude ultérieure a révélé une fréquence accrue de SNP fIFNG documentés chez les chats de race, mais un petit nombre a limité l'analyse statistique (Kedward-Dixon et al., 2020). Une étude plus large (Barker et al., 2020) publiée sur la prévalence des SNP fIFNG chez les chats sans pedigree a trouvé une association statistique entre la présence ou l'absence de PIF et le génotype ; cependant la présence du génotype « protecteur » chez 16 % des chats atteints de PIF et son absence chez 66 % des chats sans PIF limite son utilisation chez les chats individuels ou pour guider l'élevage.
Le rôle de l'immunité humorale dans la protection contre la PIF est ambigu. Il a été suggéré que les anticorps d'origine maternelle offrent une protection jusqu'à l'âge de cinq à six semaines environ (Addie et Jarrett, 1992) jusqu'à ce qu'ils déclinent et deviennent indétectables à l'âge de six à huit semaines. Cependant, une infection à l'âge de deux semaines a également été détectée (Lutz et al., 2002), remettant en cause la protection par des anticorps d'origine maternelle. D'autre part, les chats atteints d'infections entériques actives au FCoV ont de fortes réponses systémiques IgG et IgA sécrétoires muqueuses qui diminuent après la clairance du FCoV, sans preuve d'une réponse muqueuse IFN-γ T, ce qui suggère que les réponses humorales peuvent contrôler l'infection (Pearson et al ., 2019).
La production d'anticorps contre le FCoV prend 10 à 28 jours après l'infection (Meli et al., 2004 ; Vogel et al., 2010). L'élimination des infections naturelles a été associée à des anticorps dirigés contre la protéine FCoV S (Gonon et al., 1999). A l'inverse, dans les infections expérimentales, les anticorps dirigés contre la protéine S peuvent être délétères (Vennema et al., 1990). Chez les chats avec des anticorps préexistants, une «amplification dépendante des anticorps» (ADE) a été observée expérimentalement, entraînant une évolution plus rapide de la maladie et une mort plus précoce. Cette amélioration a été observée indépendamment du fait que les chats aient acquis des anticorps par immunisation passive ou active à l'aide de certaines études expérimentales sur les vaccins (Weiss et Scott, 1981 ; Vennema et al., 1990 ; De Groot et Horzinek, 1995). Cependant, dans les études de terrain, les chats ont développé une PIF lors de la première exposition au FCoV (et donc, n'avaient pas d'anticorps préexistants) et les chats ont subi des infections répétées par le FCoV sans développer de PIF, ce qui a conduit à la conclusion que l'ADE est un phénomène de laboratoire qui n'est pas important dans le monde réel (Addie et al., 1995, 2003). De plus, une étude expérimentale (Mustaffa-Kamal et al., 2019) a documenté que neuf chats sur dix qui n'avaient pas développé de PIF après une infection primaire par une souche de FCoV associée à la PIF ont résisté au développement de la maladie après un nouveau défi.
Signes cliniques
Signes cliniques associés à une infection au FCoV
Le FCoV ne provoque généralement aucun signe clinique chez les chats après une infection. Elle s'accompagne parfois d'une entérite (Sabshin et al., 2012) avec des signes cliniques de diarrhée et/ou de vomissements. Parfois, des entérites à coronavirus très graves, voire mortelles, ont été signalées (Kipar et al., 1998).
Signes cliniques associés à la PIF
Le tableau clinique de la PIF est très variable, reflétant la variabilité de la distribution des vascularites et des lésions granulomateuses. La vasculopathie peut entraîner des épanchements («humides») tandis que la formation de granulomes entraîne des lésions massives («sèches»). Une forme incluant le développement d'épanchements est considérée comme la plus fréquente (Sparkes et al., 1991 ; Tsai et al., 2011 ; Riemer et al., 2016) : 78 % des 224 cas de PIF avaient des épanchements ( Riemer et al . ., 2016 ). La distinction entre les formes dites « effusives » et « non effusives » de PIF est importante à des fins de diagnostic ; cependant, il existe un chevauchement considérable entre les deux formes, et en effet les cas de PIF avec épanchements ont également des lésions pyogranulomateuses visibles à l'autopsiel'examen et, de même, de nombreux chats avec une forme non effusive finiront par développer des épanchements. Les signes cliniques de la PIF peuvent changer avec le temps, c'est pourquoi des examens physiques répétés sont importants pour détecter les nouveaux signes cliniques apparents ; par exemple, un épanchement peut se développer ou des changements oculaires peuvent devenir visibles à l'examen ophtalmoscopique.
Des signes cliniques non spécifiques peuvent survenir chez les chats avec ou sans épanchement et comprennent la léthargie, l'anorexie et la perte de poids (ou l'incapacité à prendre du poids/un retard de croissance chez les chatons), bien que parfois certains chats restent brillants et conservent une bonne condition physique. Une fièvre, qui peut être fluctuante et modérée et typiquement <40 °C (mais peut parfois être plus élevée) et qui est réfractaire à de nombreux médicaments et ne répond pas aux antibiotiques, est couramment présente. Une étude décrivant des chats référés ayant des antécédents de fièvre a révélé que la PIF était le diagnostic le plus fréquemment posé, soulignant son importance en tant que diagnostic différentiel de la fièvre, même au niveau de référence ( Spencer et al., 2017 ). Une autre étude ( Riemer et al., 2016), qui décrit les caractéristiques cliniques de la PIF, documente la fièvre dans 55,8 % des cas de PIF. Il a été démontré que la fièvre était plus fréquente chez les chats avec épanchement que chez les chats sans épanchement ( Riemer et al., 2016 ).
La PIF peut être associée à la formation d'un épanchement dans une ou plusieurs cavités corporelles. Les épanchements abdominaux conduisant à une présentation clinique d'ascite, parfois avec distension abdominale, sont les épanchements les plus fréquemment observés avec la PIF(Fig.4).
Un épanchement pleural peut être présent en même temps qu'un épanchement abdominal. Chez certains chats, l'épanchement est limité au thorax ; les chats souffrant d'épanchement pleural peuvent présenter une dyspnée (Pedersen, 2009 ; Beatty et Barrs, 2010 ; Riemer et al., 2016). Dans une étude rétrospective portant sur 306 chats diagnostiqués avec un épanchement pleural d'étiologie établie, la PIF n'a été diagnostiquée que chez 8,5 % des chats, tandis que la maladie cardiaque était l'étiologie la plus fréquente (35,3 %), suivie de la néoplasie (30,7 %), du pyothorax (8,8 % ) et chylothorax (4,6 %). Les chats atteints de PIF étaient significativement plus jeunes que ceux atteints de maladie cardiaque et de néoplasie, et les chats atteints de maladie cardiaque avaient une température corporelle significativement plus basse, une activité sérique d'alanine aminotransférase et de phosphatase alcaline plus élevée, et des concentrations de protéines et un nombre de cellules nucléées plus faibles dans l'épanchement que les chats atteints de PIF (König et al., 2019). Épanchements péricardiques ( Fischer et al., 2012b ; Baek et al., 2017), avec ou sans épanchements dans d'autres cavités corporelles, sont aussi parfois rapportés. Rarement, un épanchement dans le scrotum est présent chez les chats mâles intacts en raison d'une sérosite impliquant la tunique vaginale des testicules, entraînant une hypertrophie du scrotum. Lorsque des épanchements se forment dans la PIF, la progression de la maladie est souvent de nature assez aiguë, progressant en quelques jours ou quelques semaines et limitant considérablement la survie ( Ritz et al., 2007 ).
Lorsque les épanchements ne sont pas présents dans les cas de PIF, la PIF est souvent plus difficile à diagnostiquer, car la fièvre, l'anorexie, la léthargie et la perte de poids (ou l'incapacité à prendre du poids chez les chatons) peuvent être les seuls signes, en particulier aux premiers stades de la maladie. Elle a également tendance à être plus chronique que la PIF associée à des épanchements, évoluant sur quelques semaines à quelques mois. Des signes supplémentaires de PIF non effusive dépendent des organes affectés par les lésions granulomateuses et peuvent inclure le système nerveux central (SNC), les yeux et/ou les organes abdominaux (tels que le foie, les ganglions lymphatiques abdominaux, les reins, le pancréas, la rate et/ou ou tractus gastro-intestinal) ( Norris et al., 2005), mais de tels signes peuvent également être observés chez les chats avec des épanchements, ils ne sont donc pas limités à la PIF non effusive. En plus des lésions granulomateuses, les reins peuvent parfois présenter une glomérulonéphrite à médiation immunitaire lorsqu'ils sont affectés par la PIF ; ceci est causé par des complexes immuns par la production excessive d'anticorps non neutralisants dans la PIF (Hartmann et al., 2020).
Une rénomégalie, mais aussi occasionnellement une réduction de la taille des reins, peuvent survenir. Une pneumonie pyogranulomateuse diffuse est parfois observée ( Trulove et al., 1992 ) provoquant des signes respiratoires. Une lymphadénomégalie abdominale peut être présente. Un ictère peut survenir (Fig. 5), plus fréquemment chez les chats présentant des épanchements, mais le degré d'hyperbilirubinémie n'est souvent pas suffisamment élevé pour entraîner un ictère clinique ( Pedersen, 2009 ; Riemer et al., 2016 ).
L'hyperbilirubinémie peut survenir en raison d'une atteinte hépatique, mais peut également être le résultat d'une anémie hémolytique à médiation immunitaire, qui peut survenir en phase terminale chez les chats atteints de PIF. Une hyperbilirubinémie légère peut être le résultat d'une interférence avec les transporteurs de la bilirubine causée par des taux élevés de TNF-alpha entraînant une réduction du transport de la bilirubine dans et hors des cellules hépatiques. L'augmentation de la bilirubine et la baisse du nombre de globules rouges laissaient présager une mort imminente dans une étude ( Tsai et al., 2011 ).
La PIF peut également se manifester dans le tractus intestinal et/ou les ganglions lymphatiques régionaux (parfois appelés « PIF focale ») se présentant généralement comme une masse abdominale palpable en raison de l'atteinte primaire des ganglions lymphatiques mésentériques et/ou du tractus intestinal. Il peut être particulièrement difficile à diagnostiquer car les lésions peuvent être difficiles à différencier initialement de la néoplasie ( Kipar et al., 1999 ), de la toxoplasmose ( Cohen et al., 2016 ) ou de l'infection mycobactérienne ( O'Halloran et Gunn-Moore, 2017 ) . La PIF impliquant le tractus intestinal peut se manifester par une entéropathie exsudative, conduisant à de faibles valeurs de protéines totales et de globuline, contrairement à la présentation habituelle de la PIF. Souvent, ces chats présentent une hypertrophie des ganglions lymphatiques mésentériques due à une lymphadénite nécrogranulomateuse (Kipar et al., 1999 ; Hugo et Heading, 2015 ), ou des lésions intestinales murales solitaires du côlon ou de la jonction iléo-caecolique avec adénopathies régionales associées ( Harvey et al., 1996 ). Les chats atteints de PIF intestinale ont généralement des antécédents de vomissements et de diarrhée ou de constipation.
Des signes dermatologiques sont parfois rapportés dans la PIF et peuvent se manifester par de multiples nodules ou papules non prurigineux ou prurigineux ( Cannon et al., 2005 ; Declercq et al., 2008 ; Bauer et al., 2013 ; Redford et Al-Dissi, 2019) , due à une phlébite/vascularite cutanée pyogranulomateuse nécrosante. Un syndrome de fragilité cutanée a également été rapporté ( Trotman et al., 2007 ). Le priapisme a été signalé à la suite de changements granulomateux dans les tissus entourant le pénis ( Rota et al., 2008 ).
La PIF neurologique peut entraîner des signes cliniques associés à des modifications focales, multifocales ou diffuses du cerveau, de la moelle épinière et des méninges. Jusqu'à 30% des chats atteints de PIF présentent des signes neurologiques ( Kline et al., 1994 ; Foley et al., 1998 ; Foley et Leutenegger, 2001 ; Negrin et al., 2007, 2010 ; Kent, 2009 ; Ives et al., 2013 ; Doenges et al., 2016 ). Parfois, les chats atteints de PIF ne présentent qu'une maladie neurologique ( Rissi, 2018 ). Trois syndromes cliniques ont été identifiés dans une étude rétrospective de la PIF neurologique ( Crawford et al., 2017); sur 24 chats, trois avaient une myélopathie T3-L3, sept avaient un syndrome vestibulaire central et 14 avaient une maladie multifocale du SNC. Les signes couramment signalés comprennent l'ataxie (avec divers degrés de tétra- ou de paraparésie; Figs. 6 et 7), l'hyperesthésie, le nystagmus, les convulsions ( Timmann et al., 2008), les modifications du comportement et de l'état mental et les déficits des nerfs crâniens. Les signes cliniques vestibulaires centraux peuvent inclure une inclinaison de la tête, une ataxie vestibulaire, un nystagmus, une apparence obtuse et des déficits de réaction posturale. Fait intéressant, une étude rétrospective (Grapes et al., 2020), qui a examiné des chats présentant une maladie vestibulaire, n'a identifié aucune caractéristique clinique discrète qui aiderait à différencier les chats atteints d'une maladie vestibulaire due à la PIF d'autres causes. Ce fut une surprise étant donné que la PIF affecte principalement les jeunes chats et est souvent associée à des signes non neurologiques concomitants. L'absence de caractéristiques cliniques spécifiquement associées à la PIF peut être due au fait que l'étude a inclus un certain nombre de chats plus jeunes avec d'autres diagnostics (polypes de l'oreille moyenne, carence en thiamine, empyème intracrânien et otite moyenne/interne) et les chats atteints d'empyème intracrânien peuvent présenter des signes systémiques non neurologiques. Il a été démontré que la fièvre était moins fréquente chez les chats atteints de PIF neurologique que chez ceux sans signes neurologiques (Riemer et al., 2016 ). Une étude rétrospective (Mella et al., 2020) de chats référés pour une enquête sur une maladie de la colonne vertébrale a révélé que la PIF était la cause chez 18 des 221 chats de l'étude ; des anomalies systémiques concomitantes et des résultats anormaux à l'examen clinique étaient significativement associés à un diagnostic de PIF, mais ces caractéristiques étaient également associées à un diagnostic de lymphome spinal (16 chats) et d'empyème (3 chats).
La PIF était la cause d'uvéite la plus fréquemment diagnostiquée dans une étude portant sur 120 chats atteints d'uvéite, dont 15,8 % avaient une PIF ( Jinks et al., 2016 ). Une étude décrivant les lésions oculaires chez 15 chats atteints de PIF a trouvé des épanchements chez 13 chats et aucun épanchement chez seulement deux chats ( Ziolkowska et al., 2017 ). Les manifestations oculaires de la PIF comprennent l'uvéite antérieure et/ou postérieure ( Foley et al., 1998 ; Norris et al., 2005 ; Jinks et al., 2016 ; Doenges et al., 2016). Les signes cliniques comprennent des modifications de la couleur de l'iris, une dyscorie ou une anisocorie secondaire à l'iritis, une perte soudaine de la vision et un hyphéma (Figs. 8 et 9). Les précipités kératiques peuvent apparaître sous forme de dépôts de «graisse de mouton» sur l'endothélium cornéen ventral (Fig. 10). L'iris peut montrer un gonflement et une surface nodulaire, et une poussée aqueuse peut être détectée. À l'examen ophtalmoscopique, on peut voir une choriorétinite, une collerette périvasculaire pelucheuse (représentant une vascularite rétinienne), des zones gonflées périvasculaires ternes de choriorétinite pyogranulomateuse, un décollement linéaire de la rétine, une poussée du vitré et des cloques liquidiennes sous la rétine.
La rhinite associée à la PIF (Andre et al., 2020) a été décrite chez un jeune chat qui présentait certains signes des voies respiratoires supérieures ainsi que d'autres signes plus typiques de la PIF ; des tests respiratoires approfondis sur écouvillons des voies respiratoires supérieures chez ce chat n'ont révélé qu'un faible résultat positif pour Mycoplasma felistandis que l'examen histopathologique des échantillons pulmonaires (et hépatiques et intestinaux) et nasaux (y compris l'immunohistochimie de l'antigène FCoV sur les échantillons nasaux) a confirmé un diagnostic de PIF. Une myocardite associée à la PIF a également été décrite chez un chat sans épanchement (Ernandes et al., 2019) ; ce cas particulier a présenté de la fièvre, un amaigrissement et une diarrhée avant de développer une dyspnée puis des signes neurologiques et oculaires de PIF. L'histopathologie de divers organes, y compris le tissu cardiaque, était compatible avec la PIF et l'immunohistochimie de l'antigène FCoV du cœur était également positive.
Diagnostic
Diagnostic de l'infection au FCoV
L'infection au FCoV n'est pas associée à des signes cliniques chez la majorité des chats ; seule une minorité développe la PIF. La confirmation de l'infection au FCoV chez les chats en bonne santé n'est pas souvent indiquée à moins que le propriétaire du ménage ne tente de contrôler l'infection au FCoV, soit pour essayer de manière générale de réduire le risque de développement de la PIF dans le ménage, soit parce qu'un cas de PIF a été diagnostiqué dans le ménage. . Plus de détails sur le diagnostic de l'infection au FCoV par RT-PCR fécale et test d'anticorps FCoV peuvent être trouvés plus loin dans les sections sur « Approche générale du contrôle du FCoV et de la PIF » et « Gestion des chats infectés par le FCoV apparemment en bonne santé ».
L'infection au FCoV s'accompagne parfois d'une entérite (Sabshin et al., 2012). Si une infection au FCoV est suspectée chez de jeunes chats souffrant de vomissements et/ou de diarrhée, le diagnostic d'infection au FCoV peut être réalisé par RT-PCR sur des échantillons fécaux ou des écouvillons rectaux. Cependant, de nombreuses autres causes d'entérite existent chez les chats, qui doivent être prises en compte avant de poser un diagnostic définitif d'entérite associée au FCoV.
Diagnostic de la PIF ( voir aussi l'outil de diagnostic ABCD FIP ici)
Cette section se concentrera sur le diagnostic de la PIF chez les chats malades présentant des signes cliniques qui pourraient être évocateurs de PIF. Un chat ne peut pas développer la PIF à moins qu'il n'ait été infecté par le FCoV et la démonstration du FCoV dans les tissus affectés et les épanchements peuvent être utiles lors des investigations diagnostiques de la PIF.
Signalisation et contexte pour FIP
Lorsque l'on aborde un cas dans lequel la PIF est considérée comme un diagnostic différentiel, il faut se rappeler que la PIF est plus fréquente chez les jeunes chats [surtout de moins de deux ans ( Riemer et al., 2016 )] et que les chats mâles présentent un risque légèrement plus élevé de maladie . (Rohrbach et al., 2001 ; Benetka et al., 2004 ; Norris et al., 2005 ; Worthing et al., 2012 ; Riemer et al., 2016 ). De plus, la plupart des chats qui développent la PIF ont déjà été hébergés dans des foyers multi-chats. Bien que certaines races se soient avérées prédisposées à la PIF dans certains pays ( Pesteanu-Somogyi et al., 2006 ; Worthing et al., 2012), on pense que cela est dû à des facteurs de risque génétiques présents dans ces races dans ces pays plutôt qu'à des prédispositions raciales généralisées existantes dans le monde entier ( Riemer et al., 2016 ). Des antécédents récents de stress (p. ex., adoption, séjour dans un refuge, stérilisation, maladie des voies respiratoires supérieures, vaccination) sont couramment apparents (Rohrer et al., 1993 ; Riemer et al., 2016 ) et peuvent contribuer au développement de la PIF chez un chat infecté par le FCoV.
Approche du diagnostic de la PIF
Chez les chats atteints de PIF qui ont un épanchement, l'échantillonnage de l'épanchement est l'étape diagnostique la plus utile dans le diagnostic de la PIF effusive ; en effet, les tests sur les épanchements ont souvent une valeur diagnostique plus élevée que les tests sur le sang ( Hartmann et al., 2003 ) et les échantillons sont souvent relativement faciles à obtenir. Si l'épanchement n'est pas important, l'imagerie peut être utilisée ( Pedersen, 2014) pour confirmer, identifier et localiser des volumes plus petits. L'échographie est généralement considérée comme étant plus sensible que la radiographie pour la détection de petits volumes de liquide dans le thorax et l'abdomen, mais cela dépend de l'endroit où résident les poches de liquide. Une échographie répétée pour identifier tout épanchement de petit volume est recommandée et, de même, l'échographie peut être utilisée pour guider l'échantillonnage de petites poches de liquide ( Tasker, 2018). Une fois qu'un épanchement est prélevé, la première chose à faire est de noter son aspect : s'il s'agit de sang franc, ou s'il peut être discerné comme de l'urine, la PIF est très peu probable. De plus, les exsudats purulents ne sont généralement pas causés par la PIF. La présence de chyle indiquera généralement d'autres maladies, telles qu'une insuffisance cardiaque, un lymphome ou une rupture du canal thoracique, mais des chats atteints de PIF avec épanchement chyleux pur ont été signalés ( Savary et al., 2001 ). Les épanchements de PIF sont généralement clairs, visqueux/collants et de couleur jaune paille (Fig. 11).

Cependant, le diagnostic de la PIF en l'absence d'épanchement peut être très difficile en raison du grand nombre de signes cliniques possibles et de la non-spécificité de la plupart d'entre eux (p. ex., anorexie, léthargie, perte de poids, pyrexie). Diagnostic étiologique des cas de PIF sans épanchements par prélèvement biopsique ante-mortempeut être très difficile en raison, par exemple, de problèmes d'accès aux tissus affectés, de contre-indications (telles que la nécessité d'une anesthésie générale) au caractère invasif des biopsies d'un chat malade et/ou des coûts liés au prélèvement de tissus. Actuellement, il n'existe aucun test de confirmation non invasif disponible pour les chats atteints de PIF qui n'ont pas d'épanchements, bien que dans certains cas, des informations précieuses puissent être obtenues grâce à l'analyse d'échantillons d'aspiration à l'aiguille fine (FNA) prélevés sur les organes affectés, s'ils sont accessibles. comme décrit plus tard.
Les informations suivantes sur le diagnostic de la PIF examineront les mérites et les inconvénients (et parfois la sensibilité et la spécificité) des tests disponibles pour le diagnostic de la PIF et de l'infection au FCoV, le cas échéant. Bien que chaque test individuel soit décrit, il convient de rappeler que lorsqu'un chat suspecté de PIF fait l'objet d'une enquête, un vétérinaire interprétera plusieurs résultats de test en même temps, tout en tenant compte du signalement et des antécédents du chat. Une telle interprétation est importante pour aider à déterminer la probabilité de PIF en tant que diagnostic, en l'absence d'un diagnostic définitif. L'avantage d'intégrer plusieurs résultats de tests lors de l'interprétation a été démontré dans une étude publiée sur le diagnostic de la PIF ( Stranieri et al., 2018) et dans un résumé discutant d'une approche d'apprentissage automatique pour le diagnostic de la PIF (Dunbar et al., 2018b).
Modification de analyses laboratoires dans la PIF
Hématologie de routine dans la PIF
Les changements hématologiques de routine ne sont pas spécifiques de la PIF, mais les anomalies courantes observées comprennent la lymphopénie (observée fréquemment mais plus chez les chats avec des épanchements que chez les chats sans), la neutrophilie, un décalage vers la gauche et une anémie normocytaire normochrome légère à modérée (Sparkes et al., 1991 , 1994 ; Rohrer, 1992 ; Norris et al., 2005 ; Tsai et al., 2011 ; Riemer et al., 2016 ). Une association entre la PIF et la microcytose (avec ou sans anémie) a été rapportée ( Riemer et al., 2016 ). Une anémie hémolytique à médiation immunitaire survient occasionnellement ( Norris et al., 2005 ; Riemer et al., 2016 ). Une diminution du nombre de globules rouges est un signe de mauvais pronostic ( Tsai et al., 2011 ).
Biochimie sérique dans la PIF
Les modifications de la biochimie sérique sont également non spécifiques chez les chats atteints de PIF, mais certaines anomalies peuvent être utiles pour faire considérer la PIF comme un diagnostic différentiel.
L'hyperglobulinémie est souvent rapportée dans la PIF et peut s'accompagner d'une hypoalbuminémie ou d'une albumine sérique faible à normale (Rohrer, 1992 ; Riemer et al., 2016 ). La présence d'hypoalbuminémie parallèlement à l'hyperglobulinémie signifie que l'hyperprotéinémie ne se produit pas toujours ( Riemer et al., 2016 ). Cette combinaison de changements peut entraîner un faible rapport albumine/globuline (A:G), et ce rapport peut être utilisé pour aider à évaluer la probabilité de PIF ; le rapport A:G a une valeur diagnostique plus élevée que la concentration totale de protéines sériques ou de globuline ( Hartmann et al., 2003 ). Divers seuils de rapport A: G ont été suggérés; par exemple, un rapport A:G <0,4 rend la PIF très probable, tandis qu'un rapport A:G >0,8 rend la PIF très improbable (Sparkes et al., 1991 ;Norris et al., 2005 ; Tsai et al., 2011 ). Une étude ( Jeffery et al., 2012 ) utilisant une population de chats avec une prévalence de PIF de 4 %, a rapporté qu'un rapport A/G sérique > 0,6 était utile pour exclure la PIF, mais que des rapports inférieurs n'étaient pas utiles pour statuant en FIP. De plus, la fréquence et l'étendue de l'hypoalbuminémie, de l'hyperglobulinémie et du faible rapport A:G rapportés chez les chats atteints de PIF ont diminué au cours des dernières années ( Riemer et al., 2016 ; Stranieri et al., 2017a ), ce qui pourrait être dû au diagnostic de PIF par les vétérinaires . plus tôt, ce qui signifie que les cas n'ont pas progressé pour montrer ces changements. Des γ-globulines polyclonales et monoclonales élevées ont été rapportées chez des chats atteints de PIF ( Taylor et al., 2010), bien que les élévations polyclonales soient beaucoup plus courantes.
Des taux élevés de bilirubine en l'absence à la fois d'hémolyse et d'élévations modérées de l'activité des enzymes hépatiques doivent faire suspecter une PIF. L'hyperbilirubinémie survient chez 22 à 63 % des chats atteints de PIF (Sparkes et al., 1991 ; Norris et al., 2005 ; Tsai et al., 2011 ; Riemer et al., 2016 ), et est particulièrement observée dans les cas de PIF qui ont épanchements ( Riemer et al., 2016 ). Des valeurs élevées de bilirubine ne sont pas toujours corrélées avec des enzymes hépatiques élevées ( Riemer et al., 2016 ), car l'hyperbilirubinémie chez les chats atteints de PIF n'est pas nécessairement le reflet d'une maladie hépatique parenchymateuse, mais peut être due à une fragilité excessive des érythrocytes entraînant une hémolyse avec une élimination réduite de produits de dégradation de l'hémoglobine ( Pedersen, 2014), ou un métabolisme altéré de la bilirubine en raison de taux élevés de TNF-alpha. ALT, AST et ALP étaient normaux chez 86, 66 et 95 %, respectivement, des chats atteints de PIF ( Riemer et al., 2016 ). Il a été constaté que le niveau de bilirubine peut augmenter à mesure que la PIF progresse et que l'augmentation des niveaux de bilirubine est un mauvais signe pronostique ( Tsai et al., 2011 ).
Comme décrit précédemment, les reins peuvent être affectés dans la PIF via des lésions granulomateuses ou une glomérulonéphrite (Hartmann et al., 2020) ; ces changements peuvent entraîner une azotémie bien que cela soit plus fréquemment observé dans les cas sans épanchements (Riemer et al., 2016).
Les protéines de phase aiguë (APP) sont produites dans le foie dans de nombreuses maladies inflammatoires et non inflammatoires en réponse aux cytokines libérées par les macrophages et les monocytes. L'APP majeure chez les chats est la glycoprotéine acide alpha1 (AGP), qui a une fonction immunomodulatrice, et des tests sont disponibles pour sa mesure dans certains laboratoires. La plage de référence pour les concentrations sériques d'AGP est < 0,48 mg/ml, et une concentration sérique modérément élevée d'AGP > 1,5 mg/ml est fréquemment rapportée chez les chats atteints de PIF ( Stranieri et al., 2018 ). L'ampleur de l'augmentation de l'AGP sérique pourrait être utile dans le diagnostic de la PIF ( Duthie et al., 1997 ; Paltrinieri et al., 2007a ; Giori et al., 2011 ; Hazuchova et al., 2016). Un rapport ( Paltrinieri et al., 2007a ) a révélé que des concentrations sériques d'AGP nettement élevées de> 3 mg / ml pouvaient étayer un diagnostic de PIF chez les chats avec une faible probabilité de maladie avant le test (c'est-à-dire avec des antécédents et des résultats cliniques non typiques de la PIF ), tandis que des élévations moins marquées étaient favorables chez les chats avec une probabilité de maladie pré-test plus élevée. Cependant, une autre étude, bien que très petite, sur des chats atteints de PIF a en fait révélé que des concentrations d'AGP modérément élevées de> 1,5 mg / ml étaient toujours capables de faire la distinction entre les chats avec et sans PIF ( Giori et al., 2011); Fait intéressant, cette étude comprenait des cas inhabituels de PIF dans lesquels certains aspects de la présentation étaient atypiques bien qu'un diagnostic de PIF ait été confirmé dans tous les cas. Cependant, il faut souligner que l'AGP n'est pas spécifique de la PIF et peut être augmentée dans d'autres maladies. Il a été suggéré qu'un AGP de ≤1,5 mg/ml pourrait être utile pour exclure la PIF ( Stranieri et al., 2018 ). Cependant, il a été constaté que les concentrations d'AGP augmentaient de manière modérée et transitoire chez tous les chats d'un ménage avant l'apparition de cas de PIF dans un environnement à infection endémique au FCoV ( Paltrinieri et al., 2007b ). Il a également été constaté que l'AGP est hyposialylée chez les chats atteints de PIF, mais généralement pas chez les chats cliniquement sains positifs aux anticorps FCoV ou chez les chats atteints d'autres maladies (Ceciliani et al., 2004 ; Rossi et Paltrinieri, 2009 ), mais les tests de sialylation de l'AGP ne sont pas disponibles en routine.
Cytologie et biochimie sur les épanchements
Comme décrit sous imagerie, l'échographie ou la radiographie peuvent être utilisées pour identifier ou confirmer la présence d'épanchements et pour aider à la collecte d'échantillons ( Pedersen, 2014 ), ce qui peut être important car avoir un échantillon d'épanchement à analyser est très utile dans le diagnostic de FIP.
Les épanchements de PIF sont hautement protéiniques, avec une concentration en protéines totales généralement > 35 g/l, compatible avec celle d'un exsudat. Une première étude ( Shelly et al., 1988 ) décrivant les caractéristiques des épanchements de 12 chats atteints de PIF a rapporté des concentrations de protéines totales de 32 à 99 g/l (médiane 59 g/l). En revanche, les numérations cellulaires des épanchements dus à la PIF sont souvent relativement faibles, généralement < 5 x 10 9 /l de cellules (ce qui serait plus cohérent avec un transsudat modifié) ; parfois le nombre de cellules est plus élevé, par exemple jusqu'à 20 x10 9/l cellules. La cytologie est typiquement de nature pyogranulomateuse avec des macrophages, des neutrophiles non dégénérés et quelques lymphocytes. Des fonds protéiques éosinophiles épais sont souvent décrits également en cytologie. Si la cytologie révèle une neutrophilie septique (généralement avec des neutrophiles dégénérés contenant des bactéries), des cellules néoplasiques ou une population lymphocytaire marquée, la PIF est hautement improbable ( Paltrinieri et al., 1999 ).
Les épanchements typiques des chats atteints de PIF ont de faibles rapports A:G ; un rapport A:G <0,4 a une valeur prédictive positive élevée, tandis qu'une valeur >0,8 a une valeur prédictive négative élevée (Shelly et al., 1988 ; Riemer et al., 2016 ). Une étude a révélé que des concentrations élevées d'AGP dans l'épanchement (> 1,55 mg/ml) étaient plus utiles (sensibilité et spécificité de 93 %) pour différencier les épanchements des chats atteints de PIF de ceux des chats sans PIF par rapport aux niveaux d'AGP dans le sérum ou d'autres protéines de phase aiguë ( Hazuchova et al., 2016 ); cependant, le diagnostic de PIF chez les chats de cette étude n'a pas toujours été confirmé.
Test au point de service de Rivalta sur les épanchements
Le test de Rivalta est un test brut au point de service qui a été développé à l'origine pour différencier un transsudat d'un exsudat chez l'homme. Cependant, il est important de noter qu'un résultat positif n'est pas spécifique à la PIF, et des résultats positifs ont été rapportés chez des chats sans PIF mais aussi chez ceux atteints de péritonite septique et de lymphome ( Fischer et al., 2012a ). La valeur prédictive positive était de 58,4 % dans une étude sur des chats présentant un épanchement, dans laquelle la prévalence de la PIF était de 34,6 % ( Fischer et al., 2012a ). Si elle est positive, la cytologie d'épanchement peut être utile pour discriminer ces causes ( Paltrinieri et al., 1999 ). Cependant, le test avait une valeur prédictive négative élevée de 93,4 % pour l'exclusion de la PIF ( Fischer et al., 2012a). Ainsi, un test de Rivalta négatif est utile car il peut être utilisé pour exclure la PIF rapidement et à moindre coût au point de service. Un résultat positif nécessite une confirmation de la PIF avec d'autres tests.
Pour effectuer le test de Rivalta, 8 ml d'eau distillée à température ambiante et une goutte d'acide acétique à 98 % (le vinaigre blanc peut être utilisé à la place) ( Fischer et al., 2013 ) sont mélangés dans un tube à essai, puis une goutte de l'épanchement est soigneusement placé ou déposé sur la surface de la solution. Un test de Rivalta positif est indiqué par la goutte restant attachée à la surface du liquide, conservant sa forme avec une connexion à la surface, ou flottant lentement au fond du tube sous forme de goutte ou de méduse (Fig. 12). Un test négatif est indiqué par la disparition de la goutte et la solution restant limpide. Cependant, l'interprétation des résultats peut être problématique en raison de la subjectivité et des difficultés à décider si un résultat est positif ou négatif ( Fischer et al., 2013). Une vidéo montrant comment effectuer le test est accessible à l' adresse http://www.youtube.com/watch?v=XmOk2veunqA :

Fig. 12. Cette image montre un test de Rivalta positif ; une goutte d'épanchement abdominal a été déposée à la surface d'un mélange de 8 ml d'eau distillée et d'une goutte d'acide acétique à 98 % (ou de vinaigre blanc ménager) et elle a conservé sa forme avec une liaison à la surface. Il ne s'agit pas d'un test très spécifique pour la FIP, mais il peut être réalisé en interne ; un test positif augmente la probabilité de PIF, tandis qu'un test négatif rend la PIF très improbable.
Analyse du liquide céphalo-rachidien (LCR)
Le LCR est généralement prélevé sur des chats présentant des signes neurologiques, bien qu'il faille être prudent avec le prélèvement de LCR cisternal car le risque de hernie cérébrale est élevé ( Negrin et al., 2007 ; Penderis, 2009 ; Rissi, 2018 ; Hoey et al., 2020) ; et par conséquent, une imagerie idéalement avancée, telle qu'une tomodensitométrie ou une IRM, doit être effectuée au préalable pour évaluer le risque potentiel d'hernie.
Les échantillons de LCR de chats atteints de PIF peuvent montrer des concentrations élevées de protéines (de >0,3 g/l [>30 mg/dl] dans les échantillons cisternaux, et >0,46 g/l [>46 mg/dl] dans les échantillons lombaires avec des plages de référence de ≤ 0,3 g/l et ≤0,46 g/l pour les échantillons de LCR cisternal et lombaire, respectivement) ; parfois des élévations marquées des protéines se produisent (> 2 g/l [200 mg/dl]). De plus, les échantillons de LCR de chats atteints de PIF ont souvent un nombre de cellules accru (>0,008 x 10 9 /l [>8 cellules/µl] dans les échantillons lombaires et/ou cisternaux ; plage de référence ≤0,008 x 10 9 /l [≤8 cellules/µl]); occasionnellement cette pléocytose est extrêmement marquée chez les chats atteints de PIF (nombre de cellules > 1x 10 9/l [>1000 cellules/µl]). L'examen cytologique du LCR peut montrer que la pléocytose est majoritairement neutrophile, mononucléaire, mixte ou pyogranulomateuse (Singh et al., 2005 ; Crawford et al., 2017 ; Felten et al., 2021). Certains chats atteints de PIF neurologique ont des résultats d'analyse du LCR sans particularité (Foley et al., 1998 ; Boettcher et al., 2007 ).
Imagerie diagnostique
Imagerie de routine : constatations échographiques et radiographiques
L'échographie ou la radiographie peuvent être utilisées pour identifier ou confirmer la présence d'épanchements et pour faciliter le prélèvement d'échantillons ( Pedersen, 2014 ). Un examen des résultats échographiques abdominaux chez 16 chats atteints de PIF ( Lewis et O'Brien, 2010) a montré la présence de liquide péritonéal dans sept cas et de liquide rétropéritonéal chez un chat. Des adénopathies abdominales ont été documentées chez neuf chats. Le foie était d'échogénicité normale chez 11 chats et variablement hypoéchogène ou hyperéchogène chez les autres. Cinq chats avaient des rebords sous-capsulaires hypoéchogènes dans un ou les deux reins. La rate était d'échogénicité normale chez la plupart des chats et hypoéchogène chez deux. Une étude échographique rétrospective (Ferreira et al., 2020) s'est concentrée sur l'importance du signe du rebord médullaire (MRS) dans les reins des chats ; sur 661 chats ayant subi une échographie abdominale, 23 chats ont reçu un diagnostic de PIF ; 15 avaient le SRM et huit n'en avaient pas, ce qui correspondait à une association significative entre la présence du SRM et la PIF. Un diagnostic de PIF a été posé par le clinicien mais aucun autre détail n'a été fourni. Un type de SRM à intensité marquée épaisse a été le plus souvent observé avec la PIF. Il est clair qu'il n'y a pas de résultats échographiques ou radiographiques spécifiques dans la PIF. L'imagerie peut également être utile pour diriger l'échantillonnage des tissus anormaux, par exemple, la FNA pour la cytologie peut être collectée pour révéler une inflammation pyogranulomateuse non septique, ou des biopsies guidées par ultrasons (par exemple Tru-Cut) peuvent être collectées et soumises pour histopathologie. La pneumonie due à la PIF qui est occasionnellement signalée peut être associée à des modifications radiographiques. Tru-Cut) biopsies (TCB) peuvent être collectées et soumises pour histopathologie. La pneumonie due à la PIF qui est occasionnellement signalée peut être associée à des modifications radiographiques. Tru-Cut) biopsies (TCB) peuvent être collectées et soumises pour histopathologie. La pneumonie due à la PIF qui est occasionnellement signalée peut être associée à des modifications radiographiques.
Imagerie avancée : imagerie par résonance magnétique (IRM) et tomodensitométrie (CT)
Lorsqu'un chat présente des signes neurologiques, l'imagerie du cerveau par IRM, si elle est disponible, peut être utile pour mettre en évidence des anomalies neurologiques dues à la PIF. Une hydrocéphalie obstructive, une syringomyélie, une hernie du foramen magnum et une amélioration marquée du contraste des méninges, du troisième ventricule, de l'aqueduc mésencéphalique et du tronc cérébral ont été signalées chez des chats atteints de PIF ( Foley et al., 1998 ; Negrin et al., 2007 ; Penderis, 2009 ; Crawford et al., 2017 ). Certains chats ne présentent des anomalies qu'après administration de produit de contraste ( Foley et al., 1998 ; Negrin et al., 2007 ), et certains chats ont une IRM normale, même après administration de produit de contraste, malgré la présence d'une méningo-encéphalite (Negrin et al., 2007 ). Une description des résultats de la tomodensitométrie chez les chats atteints de PIF neurologique n'a pas été publiée, et bien que l'hydrocéphalie et/ou la syringohydromyélie puissent parfois être détectées par tomodensitométrie, l'IRM est susceptible d'être plus sensible dans la détection de lésions intraparenchymateuses subtiles ( Negrin et al., 2009 ).
Détection directe de l'agent infectieux
Détection de l'antigène FCoV
Examen histopathologique des tissus avec immunocoloration de l'antigène FCoV
Le diagnostic définitif de la PIF repose sur des changements histopathologiques cohérents dans les tissus affectés et cela, avec l'immunomarquage de l'antigène FCoV, est considéré comme l'étalon-or pour le diagnostic .
L'immunomarquage exploite la liaison des anticorps aux antigènes FCoV associés aux cellules hôtes, qui sont ensuite visualisés par des réactions enzymatiques produisant un changement de couleur dans un processus appelé immunohistochimie (IHC). Cependant, des précautions doivent être prises pour s'assurer que des contrôles adéquats sont en place car une coloration non spécifique peut se produire, conduisant à des résultats faussement positifs (voir ci-dessous).
La lésion histopathologique de PIF « classique » est un vaisseau sanguin entouré d'une lésion inflammatoire dominée par des monocytes/macrophages entremêlés de quelques neutrophiles et lymphocytes ( Kipar et al., 2005 ), qui sont majoritairement des CD4+ ( Paltrinieri et al., 1998 ). Parfois, des monocytes peuvent être vus attachés aux cellules endothéliales ou émigrant du vaisseau ( Kipar et al., 2005 ). L'encéphalite périventriculaire et la leptoméningite sont fréquemment observées dans la PIF neurologique ( Mesquita et al., 2016 ; Rissi, 2018 ). Une étude utile (Stranieri et al., 2020b) a documenté les schémas suivants comme étant compatibles avec les lésions de PIF :
• Pyogranulomes sur une ou plusieurs surfaces séreuses ;
• Granulomes avec ou sans zones nécrotiques ;
• Infiltrats lymphocytaires et plasmacytaires dans des sites spécifiques (p. ex., infiltrat en forme de bande dans les surfaces séreuses, infiltrat périvasculaire dans les méninges et le SNC);
• Vascularite granulomateuse à nécrosante et sérite fibrineuse.
L'histopathologie seule est parfois utilisée pour diagnostiquer définitivement la PIF ( Felten et al., 2017a ). Dans une étude analysant 93 tissus de 14 chats atteints de PIF (Stranieri et al., 2020b), des lésions histopathologiques compatibles avec la PIF ont été trouvées le plus souvent dans les poumons (76,9 % des échantillons) puis les reins (64,3 %), les ganglions lymphatiques mésentériques (61,5 %). %), foie (57,1 %) et rate (57,1 %).
Cependant, en plus des modifications histopathologiques, un diagnostic définitif de la PIF doit reposer sur la démonstration d'une immunocoloration positive pour l'antigène FCoV dans les cellules appropriées (en particulier les macrophages) dans les lésions histopathologiques, comme le montre l'IHC (Kipar et al., 1998 ; Kipar et Meli, 2014 ; Stranieri et al., 2020b). L'IHC de l'antigène FCoV positif est hautement spécifique et fiable (Tammer et al., 1995; Rissi 2018; Stranieri et al., 2020b) tant qu'il est effectué avec des contrôles et des réactifs appropriés qui empêchent la liaison non spécifique de l'anticorps FCoV au tissus, sinon des résultats faussement positifs se produisent, bien que la visualisation du schéma de coloration de l'antigène FCoV par un pathologiste doive discerner une coloration non spécifique. Pourtant,Kipar et Meli, 2014 ). Si des résultats d'IHC négatifs inattendus sont obtenus, il vaut la peine de demander que des sections supplémentaires de biopsies soient coupées et examinées par le pathologiste (Tasker, 2018 ; Stranieri et al., 2020b).
Des échantillons de tissus affectés (p. ex., foie, rein, rate, ganglions lymphatiques mésentériques) peuvent être prélevés à l'autopsie ou in vivo par laparotomie, laparoscopie ou TCB guidé par ultrasons. Les échantillons les plus susceptibles d'être utiles sont ceux qui sont affectés par le processus de la maladie, et l'inférence de cela serait, espérons-le, obtenue par les résultats des tests de diagnostic (par exemple, les résultats d'imagerie, l'inflammation pyogranulomateuse sur la cytologie FNA) ainsi que les signes cliniques.
Si les chats sont euthanasiés en raison d'une suspicion de PIF, il est important d'essayer de prélever des échantillons pour la coloration IHC lors de l'examen post-mortem afin de confirmer la maladie si possible. Les résultats bruts suggèrent parfois une PIF ( Tasker et Dowgray, 2018 ) (Figs. 23 et 24), mais les lésions peuvent ne pas être évidentes. En effet, il est connu que des changements histopathologiques compatibles avec la PIF peuvent être observés dans des tissus qui n'ont pas montré de changements macroscopiques lors de l'examen post-mortem (Stranieri et al., 2020b). Les grandes lésions pyogranulomateuses peuvent être confondues avec des tumeurs (Fig. 24). Un examen histopathologique, avec coloration de l'antigène FCoV (voir ci-dessous) doit idéalement être réalisé pour confirmer le diagnostic de PIF.
Cytologie avec immunocoloration de l'antigène FCoV sur les épanchements, les FNA, le LCR et l'humeur aqueuse
L'immunocoloration FCoV peut être réalisée sur des échantillons de cytologie par immunocytochimie (ICC) ou immunofluorescence (IF), où les antigènes FCoV associés à la cellule hôte sont détectés avec des anticorps spécifiques au FCoV conjugués à des enzymes ou des marqueurs fluorescents. La présence d'antigènes FCoV peut ensuite être mise en évidence soit par des réactions enzymatiques produisant un changement de couleur (voir Figs. 25 et 26) soit par visualisation de la fluorescence à l'aide d'un microscope UV, respectivement. L'ICC peut être un test utile à effectuer sur des échantillons d'épanchements, de FNA, de LCR et d'humeur aqueuse qui présentent des caractéristiques cytologiques compatibles avec la PIF (par exemple, la présence de neutrophiles et de macrophages).
L'immunocoloration FCoV des échantillons d'épanchement a montré une sensibilité variable, allant de 57 à 100 % ( Parodi et al., 1993 ; Hirschberger et al., 1995 ; Paltrinieri et al., 1999 ; Hartmann et al., 2003 ; Litster et al., 2013 ; Felten et al., 2017c ). Étant donné que cette technique repose sur la coloration du FCoV dans les macrophages dans l'épanchement, des résultats faussement négatifs peuvent survenir (Hellemans et al., 2020) et peuvent survenir si l'épanchement est pauvre en cellules et/ou si l'antigène FCoV est masqué par des anticorps FCoV dans l'épanchement. . On pensait que l'immunomarquage était très spécifique, bien que deux des sept épanchements non PIF (l'un des deux chats avait une insuffisance cardiaque, l'autre un cholangiocarcinome) étaient positifs par IF dans une étude (Litster et al., 2013 ), et huit (trois chats atteints d'insuffisance cardiaque et cinq chats atteints de néoplasie) sur 29 épanchements non PIF ont été positifs par ICC dans un autre ( Felten et al., 2017c), remettant en cause la spécificité de la CCI. Cependant, la spécificité plus faible signalée pourrait être due à la méthodologie, et aucune de ces études n'incluait de lames de contrôle négatif. En effet, la méthodologie pour l'ICC qui comprend une double coloration pour les macrophages ainsi que l'antigène FCoV augmente potentiellement la spécificité en évitant les résultats faussement positifs de la coloration des cellules mortes ou des débris, et peut être disponible pour le diagnostic à l'avenir (Howell et al., 2020). Certains chercheurs ont utilisé des culots cellulaires préparés à partir d'échantillons d'épanchement centrifugés (Hellemans et al., 2020) pour l'IF, tandis que d'autres ont suggéré d'utiliser des culots cellulaires préparés à partir d'échantillons d'épanchement centrifugés pour préparer des échantillons fixés au formol et inclus en paraffine qui peuvent ensuite être traités comme un échantillon de tissu pour l'antigène FCoV IHC ( Kipar et Meli, 2014), pour améliorer la fiabilité de la détection de l'antigène FCoV ( Kipar et Meli, 2014 ), même si le temps de traitement requis pour ce dernier serait plus long que pour l'ICC ou l'IF.
L'immunocoloration FCoV des échantillons de FNA n'a pas encore été décrite dans de grandes études approfondies. Deux études ont décrit l'amplification réussie de l'ARN du FCoV à partir de FNA guidés par ultrasons de tissus anormaux chez 11 des 11 chats ( Freiche et al., 2016 ) et à partir de FNA de ganglions lymphatiques mésentériques (Dunbar et al., 2018a) chez 18 des 20 chats. chats atteints de PIF sans épanchements. Cet échantillonnage et cette détection d'ARN réussis suggèrent que la démonstration de l'antigène FCoV par immunocoloration sur des échantillons de cytologie pourrait également être utile chez les chats atteints de PIF si des tissus anormaux sont échantillonnés, mais cela nécessite une évaluation plus approfondie.
L'immunocoloration du FCoV à l'aide de l'ICC a été rapportée comme étant efficace pour détecter le FCoV dans le LCR d'un chat atteint de PIF neurologique ( Ives et al., 2013 ). Une étude a évalué l'ICC dans le LCR de chats avec et sans PIF, qui présentaient avec et sans signes neurologiques, recueillis lors d'un examen post-mortem ( Gruendl et al., 2016); cette étude a révélé que 17 des 20 chats atteints de PIF donnaient des résultats positifs à l'ICC mais sur 18 chats sans PIF, trois avaient également des résultats positifs (un chat avec un lymphome médiastinal, un avec une méningo-encéphalite lymphocytaire et un avec une angiopathie hypertensive avec hémorragie cérébrale), limitant la durée du test spécificité. Les raisons des résultats positifs de l'ICC chez trois chats sans PIF ne sont pas connues, mais les possibilités soulevées dans l'étude incluent la présence simultanée de PIF aux côtés des autres maladies présentes (bien que la coloration IHC des tissus neurologiques ait également été négative), la détection de la présence de FCoV systémique l'antigène en l'absence de FIP ou de coloration non spécifique et de liaison d'anticorps aberrante, bien que ceux-ci aient été jugés peu probables. Ces analyses ( Gruendl et al., 2016) ont exclu les chats qui n'avaient pas de cellules présentes dans leur LCR car l'ICC ne pouvait pas être réalisée sur ces chats. Le même groupe (Felten et al., 2021), a effectué une ICC du LCR sur deux chats présentant des signes neurologiques qui n'avaient pas de PIF et bien que l'un d'eux ait été positif, la cytologie du LCR était lymphomonocytaire, ce qui n'aurait pas été compatible avec une diagnostic de PIF. Cette même étude a également réalisé l'ICC du LCR sur sept chats avec une PIF confirmée, trois avec des signes neurologiques et quatre sans ; deux des trois chats atteints de PIF neurologique étaient positifs à l'ICC tandis que trois des quatre chats atteints de PIF non neurologique étaient positifs à l'ICC. La plupart des résultats positifs à l'ICC chez les chats PIF de cette étude ont montré une cytologie pyogranulomateuse dans le LCR, compatible avec la PIF. Application de l'ICC aux échantillons de LCR prélevés ante-mortemà partir d'un plus grand nombre de chats présentant des signes neurologiques dus à la PIF et à d'autres causes serait souhaitable pour évaluer davantage l'utilité de cette technique.
L'utilisation de l'immunomarquage de l'antigène FCoV a également été décrite dans des échantillons d'humeur aqueuse prélevés directement après l'euthanasie de 26 chats atteints de PIF confirmée et de 13 chats atteints d'autres maladies ( Felten et al., 2017b); la plupart (25 avec PIF et 11 avec d'autres maladies) de ces chats ont également été inclus dans une étude ultérieure décrivant à la fois la FCoV RT-PCR et l'immunomarquage de l'antigène FCoV chez les chats atteints de PIF (31 chats) et les chats avec d'autres maladies (27 chats) (Sangl et al., 2020). Ces deux études ont rapporté des sensibilités de 64,0 % et 62,5 %, respectivement, pour l'immunocoloration de l'antigène FCoV dans l'humeur aqueuse, mais la plupart des chats atteints de PIF dans ces études ne présentaient pas d'uvéite. Les spécificités étaient de 81,8 % et 80 %, avec des résultats positifs chez un chat témoin atteint d'un lymphome et un chat témoin atteint d'un adénocarcinome pulmonaire (chez les deux chats, la cytologie de l'humeur aqueuse n'était pas compatible avec la PIF). La cytologie d'accompagnement est donc importante pour faciliter l'interprétation. Pourtant,Felten et coll., 2017b ; Sangl et al., 2020) pourraient nécessiter des modifications (par exemple, une aiguille de plus petit calibre) pour une utilisation ante-mortem . Une évaluation plus approfondie de l'ICC sur des échantillons d'humeur aqueuse prélevés ante mortem sur des chats atteints d'uvéite due à la PIF et à d'autres causes est nécessaire pour évaluer plus avant l'utilité de l'ICC dans le diagnostic de la PIF.
Utilité comparative de l'échantillonnage de tissus et de FNA pour l'immunocoloration
Une étude a évalué l'utilité des TCB et des FNA hépatiques et rénaux, prélevés sur des chats atteints de PIF confirmés par histopathologie et immunocoloration au FCoV ( Giordano et al., 2005). La sensibilité des TCB et des FNA des tissus hépatiques et rénaux était médiocre (64 % et 82 % pour les TCB et les FNA hépatiques respectivement, et 39 % et 42 % pour les TCB et les FNA rénaux), bien que l'analyse combinée des résultats des TCB et des FNA pour chacun des augmentation de la sensibilité des tissus (jusqu'à 86 % pour le foie et 48 % pour les reins). Dans cette étude, les résultats cytologiques et histopathologiques des FNA et des TCB ont été classés selon qu'ils étaient compatibles avec la PIF pour le calcul de la spécificité et de la sensibilité. Cependant, des lésions spécifiques dans le foie et les reins n'ont pas été ciblées pour l'échantillonnage dans cette étude, et un échantillonnage ciblé sous guidage échographique pourrait améliorer la sensibilité. Une étude, comprenant 20 chats atteints de PIF, a comparé les résultats de la RT-PCR sur les FNA et les biopsies incisionnelles (IB) des ganglions lymphatiques poplités et mésentériques, du foie, de la rate, épiploon et reins par RT-PCR. Les pourcentages de résultats positifs de RT-PCR étaient similaires ou même identiques pour FNA et IB dans les organes intra-abdominaux. Bien que les résultats de l'immunomarquage pour FNA et IB n'aient pas été rapportés dans l'étude, ils fournissent toujours des informations importantes sur la valeur de l'échantillonnage par FNA ou IB, car l'obtention d'IB est très invasive et ne peut généralement pas être réalisée sans anesthésie (Emmler et al., 2020).
Détection de l'ARN du FCoV par amplification en chaîne par polymérase transcriptase inverse (RT-PCR)
La PCR est la méthode par laquelle l'ADN est amplifié de manière exponentielle à l'aide d'amorces pour cibler une séquence spécifique, permettant une détection sensible jusqu'à un très faible nombre de copies d'ADN de départ. Le traitement d'amplification post-PCR (par exemple, le séquençage) peut également être appliqué si nécessaire. La PCR n'amplifie que l'ADN, donc, parce que le FCoV est un virus à ARN, une étape pré-PCR utilisant une enzyme virale, la transcriptase inverse (RT), est nécessaire pour générer un brin d'ADNc en utilisant la matrice d'ARN du FCoV d'origine, dans un processus connu sous le nom de transcription inversée. Une combinaison de ce processus et de la PCR est connue sous le nom de RT-PCR (Barker et Tasker, 2020b). Les tests RT-PCR disponibles pour détecter l'ARN du FCoV amplifient souvent à la fois l'ARNm sous-génomique associé aux cellules (ARN produit dans les cellules félines lorsque le FCoV se réplique), ainsi que l'ARN génomique associé aux cellules et aux particules virales (qui est corrélé à la présence de FCoV entier). La liaison des amorces de PCR au génome du FCoV détermine si l'ARNm sous-génomique est préférentiellement amplifié (Barker et al., 2017 ; Barker et Tasker, 2020b). Les tests RT-PCR qui favorisent l'amplification de l'ARNm sous-génomique pourraient surestimer les charges virales FCoV présentes dans l'échantillon (Barker et Tasker, 2020b). Les laboratoires doivent être en mesure de rapporter la sensibilité et la spécificité analytiques de leurs RT-PCR et également de fournir des détails sur les contrôles positifs et négatifs qu'ils utilisent. En tant que virus à ARN, le FCoV présente un taux élevé d'erreurs lors de la réplication et toute mutation au site de liaison de l'amorce et/ou de la sonde peut entraîner une perte d'efficacité du test PCR et, finalement, de sensibilité. Les conditions de PCR peuvent être modifiées pour tolérer de telles mutations, mais cela peut entraîner une perte de spécificité ( Barker et Tasker, 2017). De plus, les RT-PCR conçues pour cibler le FCoV de type I, qui représente la majorité des souches de terrain trouvées chez les chats naturellement infectés, bien qu'il existe des variations géographiques (Hohdatsu et al., 1992; Benetka et al., 2004 ), pourraient ne pas amplifier le type II FCoV si les amorces PCR et la sonde se lient à la région du génome FCoV qui diffère entre les deux (c'est-à-dire la protéine de pointe (S)) ( Herrewegh et al., 1998 ; Terada et al., 2014 ; Decaro et al., 2021 ).
FCoV RT-PCR a été utilisé pour détecter l'ARN FCoV dans le sang, l'épanchement, les tissus (y compris les aspirations), le LCR ou les échantillons d'humeur aqueuse de cas suspects de PIF, avec des résultats variables. Les tests utilisés doivent être quantitatifs (q dans RT-qPCR) et capables de signaler la charge FCoV présente dans l'échantillon, et cette information est une aide importante à l'interprétation des résultats. En effet, une infection systémique par le FCoV peut survenir chez les chats sains et les chats sans PIF (bien que rarement) mais avec des charges virales FCoV inférieures à celles des chats atteints de PIF ( Meli et al., 2004 ; Kipar et al., 2006 , 2010 ; Desmarets et al . ., 2016 ), donc un résultat positif de RT-PCR n'est pas spécifique pour la PIF, mais des résultats positifs avec une charge FCoV élevée peuvent être utilisés pour étayer un diagnostic.
L'exécution des RT-PCR d'ARN FCoV peut être rapide, bien que, une fois le temps nécessaire pour soumettre l'échantillon au laboratoire pris en compte, la communication des résultats peut encore prendre quelques jours. Ceci est généralement plus rapide que l'immunomarquage sur des échantillons de biopsie tissulaire et souvent aussi plus rapide que l'immunomarquage sur des échantillons d'épanchement. Plus récemment, des techniques moléculaires rapides (amplification isotherme médiée par boucle) pour détecter l'ARN du FCoV en interne en tant que tests au point de service ont été décrites ( Stranieri et al., 2017b ; Gunther et al., 2018 ), mais elles souffraient d'une faible sensibilité .
FCoV RT-PCR sur des échantillons de sang
Les échantillons dérivés du sang (par exemple, le sang total, le sérum, le plasma ou les cellules mononucléaires du sang périphérique [PBMC]) peuvent être soumis à une RT-PCR pour l'ARN du FCoV après l'extraction de l'ARN, mais malheureusement, ceux-ci sont rarement positifs chez les chats atteints de PIF et ne peuvent donc pas être recommandés pour le diagnostic de la PIF. Par exemple, lorsque la FCoV RT-PCR a été réalisée sur des échantillons de plasma ou de sérum de chats avec et sans PIF ( Doenges et al., 2017 ; Felten et al., 2017a , 2017d ), bien qu'aucun des chats sans cas de PIF n'ait donné de résultats positifs , seuls 0 à 15,4 % des cas de PIF étaient positifs pour l'ARN du FCoV. De même, l'ARN du FCoV n'a été que rarement détecté dans le sang total de 20 chats atteints de PIF dans une étude expérimentale ( Pedersen et al., 2015), et bien que le sang total ou les PBMC puissent être une meilleure cible pour la RT-PCR que le sérum ( Doenges et al., 2017 ), la sensibilité était encore faible à 28,6 %. Une étude ( Stranieri et al., 2018 ) a amplifié l'ARN du FCoV par RT-PCR à partir de pastilles dérivées de sang total chez six des huit chats (75,0 %) atteints de PIF, mais aucun des huit chats atteints de maladies autres que la PIF, les résultats sont donc variables. Malgré ces études, la spécificité du FCoV RT-PCR est un problème car les chats sains et malades sans PIF peuvent avoir une virémie détectable dans le sang. Une étude ( Fish et al., 2018) ont constaté que neuf des 205 (4,4 %) chats de refuge américains en bonne santé étaient positifs à la RT-PCR pour l'ARN du FCoV dans des buffy coats préparés à partir de sang ; l'un d'entre eux avait un virus en cours de réplication dans le sang, comme en témoigne un résultat positif à la RT-PCR de l'ARNm du FCoV, et ce chaton de 8 semaines souffrait probablement de virémie. Ni ce chaton, ni sept des neuf chats positifs à la RT-PCR pour l'ARN du FCoV suivis n'ont développé de PIF au cours des six mois suivants.
FCoV RT-PCR sur les épanchements
Les échantillons d'épanchement chez les chats atteints de PIF contiennent souvent de l'ARN FCoV ( Pedersen et al., 2015 ), qui peut être détecté par RT-PCR. La centrifugation de l'échantillon d'épanchement pour obtenir un culot cellulaire à utiliser pour l'extraction d'ARN peut améliorer la sensibilité (Hellemans et al., 2020). Des études publiées avaient amplifié l'ARN du FCoV dans la plupart (72-100 %) des échantillons d'épanchement de chats atteints de PIF ( Doenges et al., 2017 ; Felten et al., 2017d ; Longstaff et al., 2017 ; Stranieri et al., 2018 ) mais généralement pas dans les épanchements de chats sans PIF ( Doenges et al., 2017 ; Felten et al., 2017d ; Longstaff et al., 2017). Cependant, des études ultérieures ont remis en question la spécificité de ce test. Une étude ( Barker et al., 2017 ) a amplifié l'ARN du FCoV, bien qu'à un faible niveau, dans le liquide abdominal de l'un des 29 chats témoins qui n'avaient pas de PIF. Une autre étude ( Felten et al., 2017a ) a amplifié l'ARN FCoV de trois (deux de ces trois avaient de faibles niveaux d'ARN FCoV) de 24 chats témoins sans PIF qui avaient des épanchements testés. Dans cette dernière étude, les chats témoins qui ont généré des résultats FCoV RT-PCR positifs avaient une néoplasie (lymphome et une tumeur maligne à cellules rondes) ou une maladie rénale chronique (ce chat avait des niveaux d'ARN FCoV plus élevés dans l'épanchement). De plus, une étude ( Stranieri et al., 2018) ARN FCoV amplifié (taux non rapportés) provenant de l'épanchement d'un chat atteint d'un carcinome intestinal (sur six chats témoins avec épanchements testés). Enfin, une autre étude (Hellemans et al., 2020) a documenté une spécificité de 81,2 % pour la RT-PCR sur les épanchements puisque des résultats positifs de RT-PCR ont été obtenus dans trois des 16 échantillons de chats sans PIF ; cependant, la confirmation de l'absence de PIF chez ces trois chats était uniquement basée sur un résultat d'immunocoloration IF négatif sur des échantillons d'épanchement des chats, et il se pourrait bien que ces trois chats aient effectivement eu une PIF. Dans l'ensemble, on peut supposer que la présence d'ARN FCoV, en particulier à des niveaux élevés, dans un épanchement qui présente également des caractéristiques cytologiques et biochimiques évocatrices de PIF, est fortement en faveur d'un diagnostic de PIF.
FCoV RT-PCR sur des échantillons de tissus et de FNA
Lorsque des échantillons de biopsie tissulaire sont obtenus à partir de chats suspects de PIF, les échantillons doivent être soumis pour histopathologie et IHC, car cela permet un diagnostic définitif de PIF. Cependant, si un retard dans l'analyse est prévu, les tissus peuvent également être soumis à la RT-PCR car la découverte de niveaux élevés d'ARN FCoV dans un échantillon d'un organe affecté peut être utile et étayer un diagnostic de PIF. En effet, on sait que les échantillons de tissus de chats atteints de PIF sont significativement plus susceptibles d'être FCoV RT-PCR positifs ( Barker et al., 2017 ; Stranieri et al., 2018 ) et ont des charges d'ARN FCoV significativement plus élevées par RT- RAP ( Porter et al., 2014), que des échantillons de tissus de chats sans PIF. Dans une étude portant sur 20 chats atteints de PIF confirmée par immunohistochimie, 70 à 90 % des IB des ganglions lymphatiques poplités et mésentériques, du foie, de la rate, de l'épiploon et des reins étaient positifs par RT-PCR (Emmler et al., 2020). Cependant, il est important de se rappeler que les chats sans PIF peuvent être positifs pour l'ARN du FCoV par RT-PCR dans les tissus. Une étude approfondie évaluant la FCoV RT-PCR dans 260 échantillons de tissus de 57 chats atteints de PIF et 258 échantillons de tissus de 45 chats sans PIF ( Barker et al., 2017 ) a révélé que 90,4 % des échantillons de tissus de chats atteints de PIF étaient FCoV RT- PCR positive contre seulement 7,8 % des échantillons de tissus de chats sans PIF.
Chez les chats atteints de PIF, les charges d'ARN FCoV sont corrélées aux résultats histopathologiques suggérant une PIF (Pedersen et al., 2015 ; Barker et al., 2017 ). Ainsi, la présence de niveaux élevés d'ARN FCoV dans des échantillons de tissus est fortement favorable à un diagnostic de PIF. Il est généralement suggéré que les échantillons de tissus ne doivent pas être fixés au formol avant la RT-PCR, car le formol peut dégrader l'ARN et diminuer la sensibilité à la PCR ( Tasker, 2018 ), bien qu'une étude ait décrit l'utilisation réussie du FCoV RT-PCR dans le formol. tissus inclus en paraffine chez les chats atteints de PIF ( Sangl et al., 2018 ).
Les FNA, tels qu'obtenus par guidage échographique, pourraient être une bonne alternative aux échantillons de tissus pour l'analyse FCoV RT-PCR, avec l'avantage d'une collecte relativement facile. Une étude ( Freiche et al., 2016) ont décrit une amplification réussie de l'ARN FCoV à partir de FNA guidés par ultrasons de tissus anormaux chez 11 chats atteints de PIF sans épanchement, suggérant que les FNA pourraient être un matériau d'échantillonnage utile pour la RT-PCR chez les chats atteints de PIF non effusive. Une étude contrôlée de la détection de l'ARN du FCoV dans les FNA prélevés dans les ganglions lymphatiques mésentériques de 20 chats atteints de PIF sans épanchement a rapporté une sensibilité de 90,0 % et une spécificité de 96,1 % (Dunbar et al., 2018a). Dans cette étude, l'ARN du FCoV a survécu à l'envoi normal car les FNA testés par RT-PCR ont été envoyés par courrier ordinaire sans glace ni conservateur d'ARN (Dunbar et al., 2018a). Comme indiqué précédemment, une étude de 20 chats atteints de PIF a comparé les résultats de la RT-PCR sur les FNA et les IB des ganglions lymphatiques poplités et mésentériques, du foie, de la rate, de l'épiploon et des reins par RT-PCR.
FCoV RT-PCR sur des échantillons de LCR
Des échantillons de LCR peuvent être soumis pour FCoV RT-PCR. Deux études ont décrit l'utilisation du FCoV RT-PCR sur des échantillons de LCR et ont trouvé qu'il avait une spécificité de 100 % pour la PIF mais une sensibilité de seulement 41,2 % ( Doenges et al., 2016 ) ou 30 % (Felten et al., 2021) dans les cas de PIF. D'autres études (Foley et al., 1998 ; Barker et al., 2017 ) ont également montré une faible sensibilité. Cependant, tous les chats inclus dans toutes ces études ne présentaient pas de signes neurologiques, car le LCR a été prélevé lors d'un examen post-mortem indépendamment des signes présentés (Doenges et al., 2016 ; Barker et al., 2017 ; Felten et al., 2021) , de sorte que la population testée ne reflète pas nécessairement une population pour laquelle des échantillons de LCR auraient été prélevés à des fins de diagnostic. En effet, dans une étude (Doenges et al., 2016 ), la sensibilité de la RT-PCR est passée à 85,7 % lorsque seuls les chats présentant des signes neurologiques et ophtalmologiques étaient pris en compte. Le même groupe a trouvé des résultats similaires chez un plus grand nombre de chats (Felten et al., 2021), où la sensibilité de la RT-PCR n'était que de 30 % lorsque les cas de PIF neurologiques et non neurologiques étaient inclus, mais atteignait 83,3 % lorsque seuls les chats atteints de PIF neurologique ont été pris en compte. Dans une étude ( Soma et al., 2018) il a été constaté que tous les échantillons de LCR avec un titre d'anticorps FCoV dans le LCR > 640 qui ont été testés pour l'ARN FCoV étaient positifs par RT-PCR. Cette étude a été limitée par le fait que la PIF n'a pas été confirmée chez tous les chats, mais elle suggère au moins une association entre des titres élevés d'anticorps contre le FCoV dans le LCR et une RT-PCR positive contre le FCoV dans le LCR. En résumé, la FCoV RT-PCR sur le LCR semble être un test supplémentaire utile chez les chats présentant des signes neurologiques, car un résultat positif soutient fortement un diagnostic de PIF, mais un résultat négatif n'exclut pas la PIF.
FCoV RT-PCR sur des échantillons d'humeur aqueuse
Des résultats positifs de FCoV RT-PCR ont été rapportés chez des chats atteints de PIF ( Barker et al., 2017 ; Dunbar et al., 2018a ; Emmler et al., 2020), bien que des échantillons aient été prélevés lors d'un examen post-mortem plutôt qu'à des fins de diagnostic. fins ante-mortem . Une vaste étude (Sangl et al., 2020) a documenté une RT-PCR FCoV positive sur des échantillons d'humeur aqueuse de 11 des 31 chats atteints de PIF confirmée et aucun des 27 chats témoins sans PIF. Encore une fois, ces échantillons ont été prélevés lors d'un examen post-mortem et, fait intéressant, seuls quatre des 31 chats atteints de PIF présentaient des signes oculaires d'uvéite, seuls deux de ces quatre chats étant positifs pour l'humeur aqueuse FCoV RT-PCR. Bien que FCoV RT-PCR ait eu une spécificité de 100 % dans cette étude, sa sensibilité était faible à 35,5 %.
FCoV RT-PCR sur les matières fécales
La FCoV RT-PCR peut être réalisée sur des échantillons fécaux, mais elle est principalement utilisée pour identifier les chats qui excrètent le FCoV pour la gestion de l'infection dans un foyer multi-chats, et elle n'est pas utilisée pour diagnostiquer la PIF, car on sait que de nombreux les chats en bonne santé sans PIF excrètent le FCoV. Deux études ont montré que 75 % et 65 % des chats atteints de PIF excrétaient le virus dans leurs selles (Addie et al., 1996 ; Barker et al., 2017). Des études testant des échantillons fécaux par RT-qPCR de 50 chats sains dans des refuges américains ( Fish et al., 2018), de 82 chats sains de chatteries allemandes (Felten et al., 2020) et de 179 chats de chatteries d'élevage allemandes (tous avec au moins 5 chats par foyer) (Klein-Richers et al., 2020) ont constaté que 56 %, 71 % et 76,5 % des chats, respectivement, étaient positifs pour l'ARN du FCoV. Bien qu'une étude ( Barker et al., 2017) ont montré que les chats atteints de PIF étaient plus susceptibles d'excréter du FCoV dans leurs selles que les chats euthanasiés en raison de maladies autres que la PIF, chez un chat individuel, la RT-PCR fécale n'est pas utile pour le diagnostic de la PIF.
Techniques moléculaires caractérisant les mutations du gène FCoV spike (S) suite à une RT-PCR positive pour l'ARN du FCoV
Suite à la détection de l'ARN du FCoV dans un échantillon par RT-PCR, diverses techniques moléculaires peuvent être utilisées pour dériver des données de séquence pour le FCoV présent. Cependant, ces techniques ne réussissent pas toujours dans les échantillons FCoV RT-PCR positifs, car de faibles niveaux de FCoV empêcheront l'analyse de séquence et la variabilité de la séquence FCoV peut empêcher les techniques de séquençage ciblées de générer des données de séquence (par exemple, certaines méthodes d'analyse de séquence ne détectent que les mutations dans le FCoV de type I , et non de type II FCoV) (Barker et al., 2017 ; Decaro et al., 2021). Comme décrit ci-dessous, une telle analyse de séquence s'est concentrée sur le gène S, et les techniques utilisées pour l'analyse comprennent le pyroséquençage, le séquençage sanger et la discrimination allélique (Barker et Tasker, 2020b).
L'analyse de la séquence d'ARN se concentre généralement sur la région du gène S du FCoV de type I dans laquelle certaines mutations ont été trouvées dans le FCoV dans les tissus de chats atteints de PIF mais pas dans le FCoV dans les fèces de chats sains sans PIF ( Chang et al., 2012 ; Decaro et al., 2021). Des études ultérieures (Porter et al., 2014 ; Barker et al., 2017 ) ont analysé le FCoV d'échantillons de tissus et de matières fécales de chats atteints de PIF et de chats sans PIF (confirmés comme ayant d'autres maladies par histopathologie). Ces études ont révélé que ces mutations du gène S ont également été trouvées dans le FCoV dans les tissus de chats sans PIF ; ils semblent donc être associés à une infection systémique par le FCoV plutôt qu'à la PIF en soi (Porter et al., 2014 ; Barker et al., 2017). Cependant, tous les échantillons dérivés « systémiques » chez les chats infectés par le FCoV ne présentent pas ces mutations. Une étude a été publiée décrivant un chat atteint de PIF neurologique (Andre et al., 2019) dans laquelle des modifications histologiques de la PIF ont été trouvées uniquement dans le système nerveux central (SNC). Le FCoV dans le SNC présentait des mutations du gène S, alors que ceux trouvés de manière systémique dans d'autres organes n'en avaient pas. De plus, une étude de sept chats restés en bonne santé après une infection expérimentale par le FCoV (Lutz et al., 2020) visait à documenter la présence ou l'absence de mutations du gène S dans des échantillons de tissus (principalement du côlon, du foie, du thymus) et des matières fécales obtenues à partir de ces chats ; Les séquences du gène S n'ont pu être obtenues que dans cinq échantillons (quatre coliques, un foie) de quatre des sept chats, mais aucun d'entre eux ne contenait les mutations du gène S. Ainsi, bien que les mutations du gène S soient susceptibles d'être importantes dans le développement de la PIF, il est proposé que c'est via ces mutations et/ou d'autres que le FCoV acquiert son tropisme monocyte/macrophage pour lui permettre de se propager de manière systémique à l'extérieur de l'intestin et contribuer à le développement du PIF. D'autres facteurs viraux sont susceptibles de permettre ensuite une réplication efficace et soutenue dans les monocytes, et l'activation des monocytes infectés, chez les chats qui développent une PIF suite à une infection systémique au FCoV (Kipar et Meli, 2014 ). Ainsi, les mutations ne peuvent être considérées comme spécifiques de la PIF.
Analyse de mutation du gène S sur des échantillons de tissus
Une étude approfondie ( Barker et al., 2017), qui comprenait 260 échantillons de tissus de 57 chats atteints de PIF et 258 échantillons de tissus de 45 chats sans PIF, a calculé que l'analyse des mutations du gène S sur les tissus, comme étape supplémentaire à la détection de l'ARN du FCoV seul par RT-qPCR, n'était que légèrement spécificité accrue pour le diagnostic de la PIF, de 92,6 % à 94,6 % (équivalent de cinq tissus), mais sensibilité modérément diminuée, de 89,8 % à 80,9 % (équivalent de 20 tissus). La diminution de la sensibilité était due à la détection de FCoV non muté chez les chats atteints de PIF (n = 4), la présence de FCoV de type II chez les chats atteints de PIF qui n'est pas détecté par les tests d'analyse de mutation qui reposent sur la recherche du gène S spécifique mutations observées dans le FCoV de type I par analyse ciblée (n = 12) et une incapacité à séquencer le gène FCoV S en raison du faible nombre de copies FCoV présentes (n = 4).
Une autre étude ( Sangl et al., 2018 ), qui a effectué une analyse de la mutation du gène S sur des échantillons de tissus regroupés (cinq par chat) de 34 chats atteints de PIF et 30 chats sans PIF, a rapporté une spécificité beaucoup plus élevée de 100 % pour l'analyse de la mutation du gène S , car aucun des 30 chats sans PIF n'a donné de résultats positifs à l'analyse des mutations du gène S. Cependant, seuls trois chats sans PIF étaient FCoV RT-PCR positifs dans cette étude, et dans aucun de ceux-ci l'analyse de la mutation du gène S n'a réussi, de sorte que le calcul de la spécificité n'était pas basé sur la détection du FCoV non muté en tant que tel. La sensibilité dans cette étude était modérée à 70,6 %, car seuls 24 des 34 cas de PIF avaient des mutations détectées.
Une étude a effectué une analyse de mutation du gène S sur les FNA et les IB des ganglions lymphatiques poplités et mésentériques, du foie, de la rate, de l'épiploon et des reins chez 20 chats atteints de PIF confirmés par immunohistochimie. Le FCoV avec des mutations du gène S était présent dans au moins un échantillon de chaque chat, mais il y avait une variation dans l'échantillon qui était positif. Le FCoV avec des mutations du gène S a été le plus fréquemment retrouvé dans les épanchements (64 %), suivi des IB de la rate, de l'épiploon et du rein (50 %), puis des IB ganglionnaires mésentériques et des FNA (45 %), et enfin dans les FNA de la rate et du foie et des IB du foie (40 %). Il y a eu une perte de sensibilité dans tous les tissus par rapport à la RT-PCR pour le FCoV sans analyse de mutation (Emmler et al., 2020).
Une autre étude d'analyse de mutation (Stranieri et al., 2018) sur les tissus (MLN, rate, intestin grêle et poumon) chez 10 chats avec PIF confirmée et huit chats avec des maladies autres que la PIF a rapporté une sensibilité de 70 % (7 chats sur 10 avec FIP avait des mutations) et une spécificité de 88 % (1 chat sur huit sans PIF avait une mutation) par rapport aux valeurs de 91 % et 50 % respectivement pour la RT-PCR seule.
Une étude (McKay et al., 2020) du Canada a documenté que seulement neuf des 20 (45%) séquences de gène S qui pouvaient être obtenues à partir de 69 échantillons de tissus montrant des résultats histopathologiques typiques de la PIF possédaient les mutations du gène S précédemment documentées associées à la maladie systémique infection ou PIF ; 15 % supplémentaires contenaient une nouvelle mutation du gène S et 40 % n'avaient aucune mutation dans la région séquencée. La sensibilité et la spécificité n'ont pas été calculées, mais il est évident que la sensibilité de l'analyse de mutation "traditionnelle" dans cette étude était faible.
Analyse de la mutation du gène S sur l'épanchement et d'autres échantillons de liquide
Une analyse de mutation du gène S a également été réalisée sur des épanchements ( Felten et al., 2017a, 2017d ; Longstaff et al., 2017 ; Stranieri et al., 2018 ) avec une sensibilité variable de 40,0 à 88,8 %. Une étude ( Barker et al., 2017 ) qui a évalué 51 échantillons de liquide (principalement des épanchements mais également du LCR et de l'humeur aqueuse) de 57 chats atteints de PIF et 47 échantillons de liquide de 45 chats sans PIF a calculé que l'analyse de la mutation du gène S, en plus de la détection du FCoV seul par RT-qPCR, n'a pas augmenté la spécificité (elle est restée à 97,9%) pour le diagnostic de PIF, mais a nettement diminué la sensibilité de 78,4% à 60%. Une autre étude ( Felten et al., 2017a) qui a effectué les mêmes calculs sur des échantillons d'épanchement, a décrit une augmentation de la spécificité de 87,5 % à 95,8 % pour l'analyse des mutations du gène S par rapport au FCoV RT-PCR seul, tandis que la sensibilité a diminué de 97,1 % à 68,6 %. Cependant, seuls les épanchements de trois chats sans PIF étaient FCoV RT-PCR-positifs et dans un seul d'entre eux, l'analyse de la mutation du gène S a réussi (lorsque le virus muté a été détecté), de sorte que l'amélioration de la spécificité n'était pas basée sur la détection du FCoV non muté. . Une autre étude (Hellemans et al., 2020) a documenté une gamme de mutations du gène S dans la majorité des échantillons d'épanchement de chats atteints de PIF.
Une autre étude (Sangl et al., 2020) évaluant des échantillons d'humeur aqueuse par FCoV RT-PCR avec analyse de mutation ultérieure a conclu que l'analyse de mutation n'était pas utile pour le diagnostic de la PIF ; dans cette étude, sur 11 échantillons d'humeur aqueuse qui étaient FCoV RT-PCR positifs chez les chats atteints de PIF, seuls quatre ont donné des résultats pour l'analyse des mutations.
Une étude (Felten et al., 2021) qui a évalué des échantillons de LCR par FCoV RT-PCR avec analyse de mutation ultérieure a également conclu que l'analyse de mutation n'était pas utile pour le diagnostic de la PIF ; dans cette étude, sur neuf échantillons de LCR qui étaient FCoV RT-PCR positifs chez les chats atteints de PIF, seuls trois ont donné des résultats pour l'analyse des mutations (tous les trois étaient positifs pour la présence de mutations du gène S). Dans cette étude, la sensibilité de l'analyse des mutations chez les chats atteints de PIF n'était que de 10 % (passant à seulement 16,7 % lorsque seuls les chats atteints de PIF neurologique étaient pris en compte) ; la spécificité de l'analyse des mutations n'a pas pu être calculée car aucun des chats sans PIF n'a donné de résultats positifs de FCoV RT-PCR sur lesquels effectuer ultérieurement une analyse des mutations.
Ces données suggèrent que la détection des mutations du gène S seule ne peut pas être considérée comme confirmant la PIF. Si elle est effectuée, il est important d'interpréter les résultats de la mutation du gène S en association avec d'autres facteurs (signal, autres résultats de test) pour déterminer la probabilité de PIF chez le chat testé. En général, l'analyse des gènes de pointe semble présenter peu d'avantages par rapport à la RT-PCR (Barker et Tasker, 2020a).
Détection indirecte de l'agent infectieux
Test d'anticorps FCoV
Test d'anticorps sur des échantillons de sang
Les tests d'anticorps FCoV sériques sont généralement des tests immuno-enzymatiques (ELISA), des tests d'anticorps d'immunofluorescence indirecte (IFA) ou des tests d'immunomigration rapide ( Addie et al., 2015 ). Le coronavirus porcin TGEV ou FCoV peut être utilisé dans ces tests comme substrats antigéniques, tous deux capables de détecter les anticorps FCoV sériques ; en effet, l'utilisation du TGEV comme substrat dans une étude (Kummrow et al., 2005) a montré une plus grande sensibilité dans la détection des anticorps FCoV sériques que l'utilisation du FCoV comme substrat. Dans la plupart des tests, les titres d'anticorps sont déterminés en multiples de dilutions de sérum. Un test d'anticorps FCoV positif indique que le chat a été en contact avec le FCoV (par infection naturelle ou vaccination) et a développé des anticorps ; cela se produit généralement environ 10 à 28 jours après l'infection naturelle ( Meli et al., 2004; Vogel et al., 2010 ). Bien que les chats atteints de PIF aient tendance à avoir des titres d'anticorps FCoV plus élevés que les chats sans PIF, il y a beaucoup de chevauchement, sans différence entre les titres médians d'anticorps FCoV chez les cas sains et suspects de PIF, de sorte que la valeur chez un chat individuel pour distinguer les chats atteints de PIF est très limitée ( Bell et al., 2006 ). Il a été suggéré qu'un résultat d'anticorps FCoV sérique négatif dans un cas suspect de PIF qui n'a pas d'épanchement est plus utile pour exclure un diagnostic de PIF que chez un chat avec épanchement ( Addie et al., 2009 , 2015; Sparkes et al., 1994). Cependant, des résultats négatifs ont été rapportés chez trois des sept chats atteints de PIF neurologique non effusive ( Negrin et al., 2007), bien que dans cette étude la méthode de test des anticorps FCoV n'ait pas été décrite. Il est important que le test d'anticorps FCoV utilisé ait une sensibilité adéquate ; sinon, des résultats faussement négatifs peuvent survenir ( Addie et al., 2015 ). Les tests d'anticorps FCoV qui commencent par une dilution de l'échantillon à 1 sur 100, ou 1 sur 400, sont généralement insensibles, manquant des titres inférieurs à la dilution de départ (c'est-à-dire ceux <100 ou <400). Seuls les tests qui ont une dilution de départ de 1:25 ou moins sont recommandés. Les opinions sur l'utilité des tests d'anticorps chez les chats suspectés d'avoir la PIF varient, mais il n'y a pas de « test d'anticorps PIF » ; tout ce qui peut être mesuré est l'anticorps contre le FCoV.
Test d'anticorps sur les épanchements
Les tests d'anticorps FCoV peuvent également être effectués sur des échantillons d'épanchement. Cependant, dans une étude, certains chats atteints de PIF (bien que le diagnostic n'ait pas été confirmé dans tous les cas) avaient des titres d'anticorps FCoV étonnamment faibles dans leurs épanchements ( Meli et al., 2013 ) et une corrélation inverse entre la charge d'ARN FCoV, mesurée par RT -qPCR et des anticorps FCoV ont été trouvés dans certains échantillons, ce qui suggère que le FCoV peut se lier aux anticorps, les rendant indisponibles en tant que ligand dans le test d'anticorps ( Meli et al., 2013 ). Les résultats faussement négatifs pour les anticorps FCoV sur les épanchements peuvent être particulièrement problématiques avec les tests d'immunomigration/immunochromatographie rapides (Meli et al., 2013 ; Addie et al., 2015). Cependant, d'autres études ( Lorusso et al., 2017; Hellemans et al., 2020) n'ont trouvé aucune preuve d'une corrélation inverse entre les charges d'ARN FCoV et les titres d'anticorps dans les épanchements de cas suspects de PIF et ces deux études ont conclu qu'une combinaison de FCoV RT-PCR et de tests d'anticorps serait plus efficace. utile pour étayer un diagnostic de PIF par rapport à l'un ou l'autre des tests seuls ( Lorusso et al., 2017 ; Hellemans et al., 2020).
Test d'anticorps sur des échantillons de LCR
Des tests d'anticorps FCoV ont été effectués sur des échantillons de LCR chez des chats atteints de PIF avec des résultats variés. Une étude ( Foley et al., 1998 ) a rapporté qu'il était utile pour diagnostiquer la PIF, avec une comparaison des titres FCoV sériques et LCR suggérant la production intrathécale d'anticorps FCoV, bien qu'aucun témoin n'ait été inclus dans cette étude. Une autre étude ( Boettcher et al., 2007 ) a trouvé une corrélation significative entre les titres d'anticorps FCoV dans le sérum et dans le LCR, suggérant que tous les anticorps FCoV dans le LCR détectés étaient dérivés du sang et que leur détection n'était donc pas utile pour le diagnostic de la PIF. Une autre étude a suggéré qu'un titre d'anticorps FCoV dans le LCR supérieur à 640 pourrait être utile pour le diagnostic de la PIF ( Soma et al., 2018), bien que le diagnostic de PIF n'ait pas été confirmé histopathologiquement chez les chats de cette étude.
Approche du traitement de la PIF
Le traitement (ou l'euthanasie) des chats suspectés de PIF ne doit être envisagé qu'après avoir fait tous les efforts possibles pour obtenir un diagnostic définitif, car un mauvais traitement peut être préjudiciable pour un chat. Des situations ont été décrites dans lesquelles un chat atteint de toxoplasmose a été diagnostiqué à tort comme pouvant avoir une PIF et a été traité avec des glucocorticoïdes avec des conséquences fatales (Cohen et al., 2016).
Historiquement, aucun traitement causal efficace n'était disponible pour la PIF, de sorte que chaque chat avec une PIF confirmée est mort ou a été euthanasié. Parfois, des chats ont survécu plusieurs mois ou années après le diagnostic (Ishida et al., 2004 ; Ritz et al., 2007 ; Pedersen, 2014 ; Hugo et Heading, 2015 ; Legendre et al., 2017) recevant un traitement, par exemple des glucocorticoïdes ou des anti-inflammatoires non stéroïdiens, mais il n'est pas clair si la survie prolongée était due au traitement. Il y a quelques rares rapports de chats "récupérés" sur le terrain, mais chez ces chats, un diagnostic définitif n'a généralement pas été obtenu ou rapporté. Actuellement, aucun médicament homologué n'est disponible qui soit efficace pour guérir la PIF, mais les nouveaux antiviraux (discutés ci-dessous, mais pas actuellement homologués) sont très prometteurs pour un traitement efficace de la PIF et sont de plus en plus utilisés.
Pronostic de la PIF
Le pronostic pour un chat atteint de PIF sans traitement antiviral efficace est extrêmement sombre. Dans une étude prospective incluant 43 chats atteints de PIF avec épanchement, la durée médiane de survie après diagnostic définitif était de huit jours (Ritz et al., 2007). Une autre étude sur des chats atteints de PIF a rapporté une durée de survie médiane de 21 jours après la présentation pour les chats avec épanchements et de 38 jours pour les chats sans épanchements (Tsai et al., 2011). En effet, certains chats, principalement ceux sans épanchements, peuvent vivre de plusieurs mois à plusieurs années (Ishida et al., 2004 ; Ritz et al., 2007 ; Hartmann et Ritz, 2008 ; Pedersen, 2014 ; Hugo et Heading, 2015 ; Legendre et al., 2017 ; Pedersen et al., 2018 ; Murphy et al., 2018 ; Tsai et al., 2011). La progression de la maladie entre l'apparition des signes cliniques et la mort est variable mais plus courte chez les jeunes chats et les chats avec épanchement que chez les chats plus âgés et les chats sans épanchement (Pedersen et al., 2014). Un chat atteint de PIF a vécu 200 jours après un diagnostic définitif (Ritz et al., 2007 ; Hartmann et Ritz, 2008), un autre a survécu 787 jours (Hugo et Heading, 2015). Un chat Birman qui n'avait jamais développé d'épanchement est mort de PIF à l'âge de six ans ; sur la base de son histoire, le chat a probablement eu une «forme bénigne» de PIF pendant de nombreuses années (Pedersen et al., 2014).
Certains paramètres peuvent prédire le temps de survie ; un mauvais état général, un faible nombre de plaquettes, un faible nombre de lymphocytes, un faible hématocrite, une concentration élevée de bilirubine, une faible concentration de sodium, une faible concentration de potassium, une activité élevée d'AST et un volume important d'épanchement indiquent un mauvais pronostic (Ritz et al., 2007 ; Tsai et al., 2011). Les convulsions peuvent également être considérées comme un signe de mauvais pronostic, car elles surviennent beaucoup plus fréquemment chez les animaux présentant une extension marquée des lésions inflammatoires du cerveau antérieur (Timmann et al., 2008).
Considérations épidémiologiques dans la prise en charge des chats suite à un diagnostic de PIF
Un chat atteint de PIF constitue-t-il une menace pour les autres chats de sa maison ?
Souvent, la question se pose de savoir s'il est dangereux de ramener un chat atteint de PIF dans un foyer avec d'autres chats. Les chats en contact ont probablement été exposés au même isolat de FCoV qui a initialement infecté le chat atteint de PIF. Pourtant, la question clé reste de savoir si le virus muté associé au passage d'une infection entérique à une infection systémique et au développement de la PIF pourrait être transmis de chat à chat. Afin de répondre à cette question, certains faits concernant l'épidémiologie du FCoV doivent être pris en compte.
Selon différentes études, 35 à 79 % des chats atteints de PIF excrètent le FCoV dans leurs selles (Addie et al., 1996 ; Chang et al., 2010 ; Porter et al., 2014 ; Barker et al., 2017). Cependant, il semble que certains chats, une fois qu'ils ont développé la PIF, cessent d'excréter le virus dans leurs selles. Une étude (Chang et al., 2010) sur 27 chats atteints d'une infection FCoV asymptomatique et 28 chats atteints de PIF provenant des mêmes ménages a révélé que 11 des 17 chats atteints de PIF n'avaient pas de FCoV intestinal détectable et ont apparemment éliminé leur infection primaire au FCoV (Chang et al ., 2010). Chez les chats souffrant de PIF avec FCoV intestinal détectable, l'analyse de séquence portant sur le gène FCoV 3c a révélé que chez tous les chats sauf un, le virus était différent de celui associé aux lésions de PIF, et semblait donc avoir été acquis par surinfection au FCoV d'autres chats. chats dans le ménage (Chang et al., 2010). Les auteurs ont conclu que si un chat atteint de PIF recommence à excréter, cela est probablement dû à une nouvelle surinfection au FCoV et non au FCoV d'origine qui a entraîné la PIF. Cependant, dans cette étude (Chang et al., 2010), le seul chat atteint de PIF qui excrétait une souche FCoV dans ses fèces similaire à la souche FCoV trouvée dans son liquide d'ascite aurait surgi en raison d'une fuite de virus systémique dans les intestins en raison, par exemple, d'un granulome intestinal. Dans une autre étude, il a été rapporté que le FCoV fécal de chats atteints de PIF peut porter les mêmes mutations du gène S que le FCoV trouvé de manière systémique (Barker et al., 2017), et une étude a révélé que les séquences d'ARN génomique complètes des souches de FCoV de terrain isolées à Cependant, dans cette étude (Chang et al., 2010), le seul chat atteint de PIF qui excrétait une souche FCoV dans ses fèces similaire à la souche FCoV trouvée dans son liquide d'ascite aurait surgi en raison d'une fuite de virus systémique dans les intestins en raison, par exemple, d'un granulome intestinal. Dans une autre étude, il a été rapporté que le FCoV fécal de chats atteints de PIF peut porter les mêmes mutations du gène S que le FCoV trouvé de manière systémique (Barker et al., 2017), et une étude a révélé que les séquences d'ARN génomique complètes des souches de FCoV de terrain isolées à Cependant, dans cette étude (Chang et al., 2010), le seul chat atteint de PIF qui excrétait une souche FCoV dans ses fèces similaire à la souche FCoV trouvée dans son liquide d'ascite aurait surgi en raison d'une fuite de virus systémique dans les intestins en raison, par exemple, d'un granulome intestinal. Dans une autre étude, il a été rapporté que le FCoV fécal de chats atteints de PIF peut porter les mêmes mutations du gène S que le FCoV trouvé de manière systémique (Barker et al., 2017), et une étude a révélé que les séquences d'ARN génomique complètes des souches de FCoV de terrain isolées àautopsiel'examen du jéjunum et du foie d'un chat atteint de PIF a révélé 100 % d'identité nucléotidique entre les séquences d'ARN viral dérivées entériques (jéjunum) et non entériques (foie), suggérant que le FCoV associé à la FIP peut être excrété dans certaines circonstances (Dye et Sidedel, 2007). Cependant, même si le FCoV associé à la PIF est excrété dans les fèces des chats atteints de PIF, il peut ne pas provoquer de PIF après transmission à un autre chat, car une étude a démontré que les fèces de chats atteints de PIF n'ont pas causé de PIF chez un autre chat (Pedersen et al. , 2012). La compréhension actuelle est que la transmission horizontale de la PIF, via une souche FCoV associée à la FIP, ne semble pas se produire très fréquemment, voire pas du tout. Bien qu'il n'y ait aucune preuve claire que la maladie PIF soit transmise de chat à chat dans des circonstances naturelles, la PIF peut être induite expérimentalement,
Par conséquent, sur la base des connaissances actuelles, il est probablement relativement sûr de ramener un chat atteint de PIF dans un foyer avec des chats qui ont déjà été en contact avec lui, car ces chats sont probablement déjà infectés par le FCoV. Il n'est cependant pas recommandé que le chat atteint de PIF entre en contact avec un chat «naïf» non infecté par le FCoV, car si le chat atteint de PIF excrète le FCoV, il pourrait infecter n'importe quel chat naïf avec le FCoV.
Dans les ménages où un chat atteint de PIF a été euthanasié, sans chat restant dans le ménage, il est recommandé que le propriétaire attende deux mois avant d'obtenir de nouveaux chats, car il a été suggéré que le FCoV conserve son infectivité pendant des jours à quelques semaines , selon les conditions environnementales (Scott, 1988), comme dans les matières fécales desséchées.
Prise en charge des chats atteints de PIF en cabinet vétérinaire
Les chats atteints de PIF dans un cabinet vétérinaire ou un hôpital doivent être manipulés et hébergés comme n'importe quel autre chat, car tout chat est une source potentielle d'infection au FCoV, et des mesures d'hygiène de routine doivent être prises. Ainsi, il n'y a aucun avantage à isoler le chat atteint de PIF et il n'est pas nécessaire de garder les chats atteints de PIF dans des services d'isolement pour maladies infectieuses.
Agents utilisés dans le traitement de la PIF
Soutien, y compris drainage anti-inflammatoire et épanchement, traitements de la PIF
La PIF est une maladie à médiation immunitaire ; ainsi, le traitement symptomatique vise à contrôler la réponse immunitaire au FCoV et consiste en de fortes doses de médicaments immunosuppresseurs ou anti-inflammatoires qui ralentissent la progression de la maladie, comme la prednisolone (initialement 2-4 mg/kg q24h PO), qui pourrait diminuer lentement si le chat répond au traitement. Bien qu'utilisés dans de nombreux cas publiés et sur le terrain, l'effet des glucocorticoïdes n'a jamais été étayé par des études contrôlées. Cependant, deux études contrôlées en double aveugle distinctes qui ont évalué l'interféron-oméga félin (Ritz et al., 2007) et la propentofylline (Fischer et al., 2011) comme traitements de la PIF ont donné à tous les chats (à la fois ceux du traitement et ceux du groupes témoins) traitement aux glucocorticoïdes ; les chats ayant reçu les médicaments supplémentaires n'ont pas survécu plus longtemps que ceux ayant reçu uniquement des glucocorticoïdes et, en effet, ceux sous glucocorticoïdes n'ont survécu que pendant une durée médiane de huit jours, confirmant un mauvais résultat avec ce traitement seul chez ces chats (Izes et al., 2020c ). Dans une étude, les chats sans épanchement traités à la fois avec des glucocorticoïdes systémiques et l'immunomodulateur polyprényl immunostimulant (IPP) avaient une survie plus faible que ceux traités avec des IPP seuls (Legendre et al., 2017) ; cependant, un diagnostic définitif de PIF n'a pas été établi chez tous les chats de cette étude. les chats sans épanchement traités à la fois avec des glucocorticoïdes systémiques et l'immunomodulateur polyprényl immunostimulant (IPP) avaient une survie plus faible que ceux traités avec des IPP seuls (Legendre et al., 2017) ; cependant, un diagnostic définitif de PIF n'a pas été établi chez tous les chats de cette étude. les chats sans épanchement traités à la fois avec des glucocorticoïdes systémiques et l'immunomodulateur polyprényl immunostimulant (IPP) avaient une survie plus faible que ceux traités avec des IPP seuls (Legendre et al., 2017) ; cependant, un diagnostic définitif de PIF n'a pas été établi chez tous les chats de cette étude.
En cas d'épanchement, certains chats bénéficient d'un retrait quotidien de l'épanchement (en particulier si les épanchements pleuraux entraînent une dyspnée) et d'une injection de dexaméthasone dans la cavité abdominale ou thoracique (1 mg/kg q24h jusqu'à ce que l'épanchement ne se produise plus, jusqu'à à sept jours – si un épanchement est présent dans les deux cavités, la dose par cavité doit être divisée) (Hartmann et Ritz, 2008). Le cyclophosphamide (2-4 mg/kg quatre fois par semaine PO) seul ou en association avec des glucocorticoïdes a parfois été utilisé mais il n'existe pas de données sur son efficacité. Si indiqué, les chats doivent également être traités avec des antibiotiques à large spectre (par exemple, tant que l'épanchement est retiré) et une thérapie de soutien (par exemple, des fluides) (Hartmann et Ritz, 2008).
Un inhibiteur de la thromboxane synthétase (chlorhydrate d'ozagrel) qui inhibe l'agrégation plaquettaire et la libération de cytokines a été utilisé chez deux chats avec une certaine amélioration des signes cliniques (Watari et al., 1998), mais il ne s'agissait pas d'une étude contrôlée.
Une étude contrôlée par placebo chez un petit nombre de chats (trois traités, trois placebo) atteints de PIF induite expérimentalement a trouvé un effet bénéfique possible d'un traitement avec des anticorps agissant contre le facteur de nécrose tumorale féline alpha (TNF-alpha) (Doki et al., 2016 ). La progression vers la PIF a été empêchée chez deux des trois chats traités avec ces anticorps, alors que les trois chats ont développé une PIF dans le groupe placebo. On pense que le TNF-alpha est impliqué dans la réplication du FCoV dans les macrophages (Takano et al., 2007a) et contribue au développement de signes cliniques chez les chats atteints de PIF. Une très petite étude non contrôlée a été publiée qui utilisait un traitement par anticorps anti-TNF-alpha humain aux côtés de l'itraconazole (Doki et al., 2020b) ; seuls trois des 10 chats inoculés dans cette étude expérimentale ont développé une PIF, et deux de ces trois chats se sont améliorés avec le traitement.
La pentoxyfylline ou la propentofylline ont été appliquées aux chats atteints de PIF parce qu'elles peuvent réguler à la baisse les cytokines pro-inflammatoires qui, à leur tour, sont censées augmenter la vascularite. Cependant, dans une étude en double aveugle contrôlée contre placebo chez des chats atteints de PIF confirmée, il n'y a pas eu de différence significative dans le temps de survie, la qualité de vie ou tout autre paramètre clinique ou de laboratoire chez les chats traités par propentofylline par rapport aux chats recevant un placebo (tous les chats ont reçu glucocorticoïdes dans cette étude) (Fischer et al., 2011).
Traitements antiviraux et immunomodulateurs de la PIF
Actuellement, aucun médicament homologué ne s'est avéré efficace pour guérir la PIF, bien que des composés antiviraux spécifiques se révèlent désormais très prometteurs. Pour de nombreux médicaments, l'évaluation des données est entravée par le manque d'essais cliniques bien contrôlés dans lesquels les nouveaux traitements sont comparés à un traitement standard ou à un placebo et le fait que la présence de PIF n'a pas toujours été confirmée dans ces études avant le début du traitement, ce qui rend impossible une évaluation du résultat (Hartmann et Ritz, 2008). Certains médicaments très prometteurs ont été développés et évalués pour le traitement de la PIF mais ne sont pas encore disponibles dans le commerce, comme les analogues nucléosidiques et les inhibiteurs de protéinase (Sharun et al., 2021). En outre, il existe également des approches expérimentales prometteuses, y compris l'inhibition de la liaison de la protéine de pointe FCoV aux récepteurs sur la membrane de la cellule hôte qui médie la fusion de l'enveloppe virale avec les membranes de la cellule hôte (Kim et al., 2013; Liu et al., 2013), ARN oligonucléotidique formant une triple hélice circulaire ciblant l'ARN viral (Choong et al., 2014), les inhibiteurs de la synthèse et du transport du cholestérol (dont l'itraconazole) induisant l'accumulation de cholestérol dans les cellules et inhibant ainsi la réplication du FCoV (Takano et al., 2017 ; Takano et al., 2019 ; Doki et al. , 2020a), ou de petits ARN interférents (siRNA) conduisant à une interférence ARN et donc à une inhibition de la réplication virale (McDonagh et al., 2011 ; McDonagh et al., 2015), mais la plupart de ces composés sont encore à un stade expérimental. Certains médicaments sont efficaces 2013), des ARN oligonucléotidiques formant une triple hélice circulaire ciblant l'ARN viral (Choong et al., 2014), des inhibiteurs de la synthèse et du transport du cholestérol (dont l'itraconazole) induisant l'accumulation de cholestérol dans les cellules et inhibant ainsi la réplication du FCoV (Takano et al., 2017 ; Takano et al., 2019 ; Doki et al., 2020a), ou de petits ARN interférents (siARN) entraînant une interférence ARN et donc une inhibition de la réplication du virus (McDonagh et al., 2011 ; McDonagh et al., 2015), mais la plupart de ces composés sont encore au stade de l'investigation. Certains médicaments sont efficaces 2013), des ARN oligonucléotidiques formant une triple hélice circulaire ciblant l'ARN viral (Choong et al., 2014), des inhibiteurs de la synthèse et du transport du cholestérol (dont l'itraconazole) induisant l'accumulation de cholestérol dans les cellules et inhibant ainsi la réplication du FCoV (Takano et al., 2017 ; Takano et al., 2019 ; Doki et al., 2020a), ou de petits ARN interférents (siARN) entraînant une interférence ARN et donc une inhibition de la réplication du virus (McDonagh et al., 2011 ; McDonagh et al., 2015), mais la plupart de ces composés sont encore au stade de l'investigation. Certains médicaments sont efficaces Doki et al., 2020a), ou de petits ARN interférents (siRNA) conduisant à une interférence ARN et donc à une inhibition de la réplication virale (McDonagh et al., 2011 ; McDonagh et al., 2015), mais la plupart de ces composés sont encore en une phase d'investigation. Certains médicaments sont efficaces Doki et al., 2020a), ou de petits ARN interférents (siRNA) conduisant à une interférence ARN et donc à une inhibition de la réplication virale (McDonagh et al., 2011 ; McDonagh et al., 2015), mais la plupart de ces composés sont encore en une phase d'investigation. Certains médicaments sont efficacesin vitro , mais sont trop toxiques pour les chats, comme la ribavirine (Weiss et Oostrom-Ram, 1989; Weiss et al., 1993a, 1993b) ou la petite molécule chloroquine (Takano et al., 2013; McDonagh et al., 2014 )). Plus d'hydroxychloroquine, dans des études in vitro (Takano et al., 2020), a été suggérée comme alternative moins toxique à la chloroquine. Le mécanisme d'action des propriétés antivirales de la petite molécule méfloquine n'est pas connu (McDonagh et al., 2014 ; Yu et al., 2020) mais son métabolisme hépatique a été étudié in vitro(Izes et al., 2020a) ainsi que sa pharmacocinétique chez les chats sains (Yu et al., 2020) et ses propriétés de liaison aux protéines plasmatiques dans le plasma des chats sains et des chats atteints de PIF (Izes et al., 2020b) ; d'autres études sont nécessaires sur sa pharmacocinétique chez les chats atteints de PIF. D'autres médicaments n'ont été étudiés qu'in vitro , mais l'efficacité in vivo est inconnue, comme la vidarabine (Barlough et Scott, 1990) qui inhibe les polymérases ; le nelfinavir, un inhibiteur de protéase disponible dans le commerce du virus de l'immunodéficience humaine ; et l'agglutinine de Galanthus nivalis (GNA), un agent liant les glucides qui se lie aux glycoprotéines d'enveloppe glycosylées par le FCoV, inhibant ainsi l'attachement viral à la cellule hôte (van der Meer et al., 2007 ; Hsieh et al., 2010).
Ciclosporine A
La cyclosporine A peut agir comme un médicament antiviral car elle se lie aux cyclophilines cellulaires, inhibant ainsi la calcineurine, qui est requise par de nombreux virus pour la réplication (Tanaka et al., 2012, 2013). La cyclosporine A inhibe la réplication du FCoV in vitro (Tanaka et al., 2012). La cyclosporine A était également associée à une réduction du volume de liquide pleural et à une diminution de la charge virale chez un chat atteint de PIF, mais le chat a succombé à la PIF 264 jours après le début du traitement (Tanaka et al., 2015). Ainsi, la cyclosporine A pourrait être une option en combinaison avec d'autres agents thérapeutiques. Jusqu'à présent, cependant, des études cliniques bien contrôlées manquent.
Curcumine
La curcumine, un dérivé du curcuma, possède des propriétés anti-inflammatoires et antivirales. Des nanoparticules de chitosane encapsulées dans la curcumine (Cur-CS), créées pour augmenter la biodisponibilité de la curcumine, ont été évaluées in vitro et se sont révélées capables de diminuer les protéines liées au système immunitaire produites lors de l'infection de cultures cellulaires par un virus associé à la FIP, ainsi que d'inhiber les virus. réplication (Ng et al., 2020). La même étude a confirmé la biodisponibilité accrue de Cur-CS par rapport à la curcumine dans l'analyse pharmacocinétique chez des chats en bonne santé. Cependant, une autre étude in vitro n'a trouvé aucun effet inhibiteur de la curcumine sur la prolifération du FCoV (McDonagh et al., 2014). Ainsi, d'autres études sur cet agent sont nécessaires.
Interférons
Les interférons sont fréquemment utilisés chez les chats atteints de PIF. L'interféron-alpha humain s'est avéré efficace contre une souche FCoV associée à la PIF in vitro , mais dans une étude de traitement contrôlée par placebo incluant 74 chats exempts d'agents pathogènes spécifiques chez lesquels la PIF a été induite expérimentalement, ni l'administration prophylactique ni thérapeutique de doses élevées (10 4 ou 10 6 UI/kg) d'interféron-alpha, d'interféron-bêta félin (10 3 UI/kg), de l'immunomodulateur Propionibacterium acnes (0,4 mg/chat ou 4 mg/chat) ou d'une combinaison, a réduit significativement la mortalité chez les animaux traités par rapport chats non traités (Weiss et al., 1990). Cependant, chez les chats traités avec 10 6 UI/kg d'interféron-alpha en association avecPropionibacterium acnes , la durée moyenne de survie a été prolongée, mais seulement de trois semaines (Weiss et al., 1990). Pour expliquer l'efficacité limitée de l'interféron-alpha, il a été suggéré que la protéine accessoire 7a codée par ORF-7 des souches associées à la FIP peut agir comme antagonistes de l'interféron de type I et contrecarrer la réponse antivirale induite par l'interféron-alpha (Dedeurwaerder et al., 2014). L'interféron-oméga félin, qui est autorisé dans de nombreux pays européens, inhibe la réplication du FCoV in vitro(Mochizuki et al., 1994). Des résultats positifs préliminaires ont été obtenus dans un essai non contrôlé, mais la PIF n'a pas été confirmée dans les cas qui ont survécu (Ishida et al., 2004). Dans un essai de traitement randomisé en double aveugle contrôlé par placebo chez 37 chats atteints de PIF confirmée, les niveaux d'interféron-oméga félin et immunosuppresseurs de glucocorticoïdes n'étaient pas plus efficaces que les glucocorticoïdes seuls (Ritz et al., 2007). Un in vitro publiéUne étude évaluant la combinaison d'hydroxychloroquine avec l'interféron-oméga (Takano et al., 2020) a révélé que l'ajout d'interféron-oméga augmentait l'action antivirale pour la réplication du FCoV de type I, suggérant d'envisager des combinaisons de traitement. L'interféron-oméga félin oral a été utilisé dans un cas de PIF qui a répondu avec succès au traitement (Addie et al., 2020b), mais l'interféron-oméga a été administré après 56 jours de traitement antiviral avec un analogue nucléosidique de l'adénosine par voie orale, de sorte que l'efficacité supplémentaire de l'interféron-oméga n'est pas claire.
Inhibiteurs de protéase
De nouveaux médicaments très prometteurs comprennent des inhibiteurs de protéase qui empêchent la réplication virale en se liant sélectivement aux protéases virales et en bloquant le clivage protéolytique des précurseurs protéiques nécessaires à la production de particules virales infectieuses. Des inhibiteurs qui ciblent la protéase de type 3C avec une activité à large spectre contre les coronavirus humains et animaux ont été créés (Kim et al., 2013). Un inhibiteur de protéase de type 3C, GC376, a montré une forte activité contre le FCoV in vitro(Kim et al., 2016) et était efficace dans le traitement de la PIF dans un cadre expérimental ; sur huit chats atteints de PIF induite expérimentalement, six sont restés en bonne santé pendant une période de suivi de huit mois (Kim et al., 2016), bien qu'un de ces six chats ait succombé à une PIF neurologique par la suite (Pedersen et al., 2018). Dans un essai sur le terrain, une cohorte de 20 chats appartenant à des clients ont été traités avec GC376 à 15 mg/kg SC q12h ; il s'agissait d'une dose plus élevée que celle utilisée dans l'étude expérimentale (Kim et al., 2016) en raison de l'échec du traitement chez le premier chat inscrit à l'essai. Dix-neuf des 20 chats traités ont retrouvé la santé dans les deux semaines suivant le traitement. Cependant, les signes de la maladie sont réapparus une à sept semaines après le traitement primaire. Des rechutes ne répondant plus au traitement sont survenues chez 12 chats sur 19 dans un délai d'une à sept semaines après le traitement initial ou répété. La plupart de ces chats en rechute ont développé une PIF neurologique. Au moment de la rédaction de cet article, 7/20 chats étaient en rémission de la maladie (Pedersen et al., 2018) ; la plupart d'entre eux étaient des chats qui s'étaient présentés à un jeune âge avec un épanchement. Les chats présentant des signes neurologiques avaient été exclus de l'étude car GC376 ne semble pas pénétrer dans le SNC. Certains effets secondaires se sont produits et comprenaient des réactions au site d'injection et un retard de développement ou une éruption anormale des dents permanentes (Pedersen et al., 2018). Aucun témoin non traité n'a été utilisé dans cette étude et la PIF n'a pas été confirmée chez tous les chats présentant une histopathologie et/ou une immunocoloration de l'antigène FCoV, ce qui entrave l'interprétation des données. Compte tenu des études sur ce médicament, cependant, les inhibiteurs de la protéase pourraient être une nouvelle approche prometteuse, surtout s'ils sont combinés avec d'autres médicaments antiviraux,
Analogues nucléosidiques
Une autre approche de traitement prometteuse est l'utilisation d'analogues nucléosidiques qui agissent comme un substrat alternatif pour la synthèse de l'ARN viral, entraînant la terminaison de la chaîne d'ARN lors de la transcription de l'ARN viral via l'inhibition de l'ARN polymérase dépendante de l'ARN. Un de ces analogues nucléosidiques, le composé GS-441524, s'est avéré non toxique in vitroet inhibe efficacement la réplication des souches de FCoV associées à la FIP et des isolats de terrain dans deux systèmes de culture cellulaire différents. Chez 10 jeunes chats atteints de PIF induite expérimentalement, le GS-441524 (appliqué SQ q 12 h) a provoqué une inversion rapide des signes cliniques et un retour à un état cliniquement sain dans les deux semaines de traitement chez les 10 chats. Deux des 10 chats traités ont présenté des récidives de signes cliniques à quatre semaines et six semaines après le traitement, respectivement. Ces deux chats ont été traités une deuxième fois avec le GS-441524 pendant deux semaines et ils ont de nouveau répondu, de manière identique à la réponse observée avec le premier traitement. Les 10 chats sont restés cliniquement sains jusqu'au moment de la publication (> huit mois après l'infection) (Murphy et al., 2018). Aucun signe de toxicité n'a été noté en dehors d'une réaction transitoire d'injection "piquante" chez certains chats, comme une posture inhabituelle, un léchage au site d'injection et/ou des vocalisations, directement après l'administration du composé (Murphy et al., 2018). Le traitement au GS-441524 a également été évalué dans une étude de terrain sur 31 chats atteints de PIF (Pedersen et al., 2019). Les chats ont été diagnostiqués avec une PIF sur la base du signalement, des antécédents, de l'examen clinique, des résultats des tests antérieurs, des tests répétés et/ou de l'analyse des épanchements, et une RT-PCR FCoV effectuée sur les épanchements chez certains chats. IHC tissulaire pour l'antigène FCoV qui a confirmé que la PIF n'a été réalisée que sur cinq chats qui ont ensuite subi les résultats des tests antérieurs, les tests répétés et/ou l'analyse de l'épanchement, et la RT-PCR FCoV effectuée sur les épanchements chez certains chats. IHC tissulaire pour l'antigène FCoV qui a confirmé que la PIF n'a été réalisée que sur cinq chats qui ont ensuite subi les résultats des tests antérieurs, les tests répétés et/ou l'analyse de l'épanchement, et la RT-PCR FCoV effectuée sur les épanchements chez certains chats. IHC tissulaire pour l'antigène FCoV qui a confirmé que la PIF n'a été réalisée que sur cinq chats qui ont ensuite subiautopsieexamen. Les chats présentant des signes neurologiques ou oculaires ont été découragés de l'essai en raison des inquiétudes suscitées par l'essai expérimental concernant la mauvaise pénétration du GS-441524 dans le cerveau et/ou les yeux (Murphy et al., 2018). Sur les 31 chats atteints de PIF recrutés dans cette étude (Pedersen et al., 2019), cinq n'avaient aucun signe d'épanchement. Les chats étaient âgés de 3 à 73 mois (moyenne de 14 mois). Les chats ont commencé un traitement primaire de GS-441524 à une dose de 2 mg/kg SQ q 24 h pendant au moins 12 semaines (avec plus de 12 semaines de traitement administré si les taux de protéines sériques restaient élevés). La posologie a été augmentée à 4 mg/kg SQ q 24 h pour les traitements ultérieurs de l'essai lorsque les chats présentaient une rechute ou lorsqu'un traitement de plus de 12 semaines était jugé nécessaire. L'étude n'incluait pas de groupe témoin traité avec un placebo ou un protocole de soins standard. Cinq des 31 chats sont morts ou ont été euthanasiés dans les 26 jours suivant le premier traitement. Les 26 chats restants ont terminé 12 semaines ou plus de traitement au GS-441524 et ont montré une amélioration clinique rapide en deux semaines. Sur ces 26 chats, 18 sont restés en bonne santé, tandis que huit autres ont présenté des rechutes de PIF (six chats PIF non neurologique et deux chats PIF neurologique) à une moyenne de 23 jours après le traitement. Trois des huit chats avec des rechutes ont été traités à nouveau avec GS-441524 à 2 mg/kg SQ q 24 h ; l'un de ces trois chats a rechuté avec une PIF neurologique et a été euthanasié tandis que les deux chats restants ont bien répondu mais ont rechuté avec une PIF à nouveau et ont été traités à nouveau avec du GS-441524 mais à une dose plus élevée de 4 mg/kg SQ q 24 h. Sur les 31 chats d'origine, 25 ont été classés comme survivants de longue date après un traitement réussi, mais l'un de ces chats a ensuite été euthanasié en raison d'une maladie cardiaque vraisemblablement non liée, tandis que 24 sont toujours en bonne santé au moment de la publication (Pedersen et al., 2019). Par la suite, une série de cas décrivant le traitement par GS-441524 (à une dose plus élevée de 5-10 mg/kg SQ q 24 h pendant au moins 12 semaines) chez quatre chats présentant des signes neurologiques et oculaires de PIF a été publiée (Dickinson et al., 2020) documentant des résultats très prometteurs. Trois des quatre chats étaient vivants et hors traitement au moment de la publication, 354 à 528 jours après le début du traitement ; deux chats avaient reçu 5 mg/kg SQ q 24 h et un chat une dose croissante à 10 mg/kg SQ q 24 h. Le chat restant a été euthanasié 216 jours après le début du traitement ; ce chat n'avait pas montré de résolution complète des signes sous traitement (5 mg/kg SQ q 24 h) et une régression clinique rapide s'est produite à l'arrêt du traitement.
Les études décrites ci-dessus ont toutes administré les analogues nucléosidiques par voie sous-cutanée. D'autres conseils concernant la manière dont le GS-441524 peut être utilisé dans le traitement de la PIF évoluent en permanence (Pedersen, 2021b), y compris des recommandations sur la dose, la durée, la surveillance et les éventuels effets secondaires du traitement. Il semble que les chats plus jeunes sans signes neurologiques ou oculaires soient ceux qui ont tendance à se comporter le plus favorablement avec un traitement sous-cutané recommandé pendant 12 semaines ; un taux de réussite global de plus de 80 % pour le GS-441524 a été cité par les personnes les plus expérimentées dans son utilisation (Pedersen, 2021b). Des effets secondaires rénaux mineurs sont signalés ainsi que des réactions de type vascularite (différentes des réactions au site d'injection qui peuvent également survenir) qui peuvent répondre à une faible dose de stéroïdes à court terme (Pedersen, 2021b).
Il y a eu un rapport de traitement réussi de la PIF avec une préparation orale d'un analogue de nucléoside ; il s'agissait d'un chat présentant des signes oculaires en l'absence d'épanchements (Addie et al., 2020b). Le nouvel analogue nucléosidique oral utilisé est appelé «Mutian» (le constituant est en instance de brevet [2020], donc l'identité de l'agent n'est pas disponible bien qu'il soit suggéré qu'il s'agisse du GS-441524 (Pedersen, 2020a)) et a été administré PO pendant 50 jours, initialement à la dose de 8 mg/kg. Quelques semaines après le début du traitement, le chat a montré une nette amélioration du poids, des signes oculaires et divers troubles hématologiques (par exemple, normalisation de l'hématocrite) et biochimiques (par exemple, réductions marquées des mesures d'AGP et de globuline et augmentation du rapport A:G ) des mesures. Le chat a également reçu de la prednisolone anti-inflammatoire pendant les 6 premiers jours, et l'interféron-oméga PO félin, suite à la finition du traitement Mutian, qui était en cours au moment de la publication. Le chat semblait avoir été guéri de la PIF. Aucun effet secondaire du traitement n'a été noté bien que le chat ait eu une augmentation des concentrations de diméthylarginine symétrique (SDMA) pendant le traitement (mais les niveaux de base avant le traitement n'ont pas été mesurés) qui ont diminué après l'arrêt du Mutian. Ce chat a également reçu une supplémentation en SAMe aux côtés de Mutian pour protéger le foie. Aucun effet secondaire du traitement n'a été noté bien que le chat ait eu une augmentation des concentrations de diméthylarginine symétrique (SDMA) pendant le traitement (mais les niveaux de base avant le traitement n'ont pas été mesurés) qui ont diminué après l'arrêt du Mutian. Ce chat a également reçu une supplémentation en SAMe aux côtés de Mutian pour protéger le foie. Aucun effet secondaire du traitement n'a été noté bien que le chat ait eu une augmentation des concentrations de diméthylarginine symétrique (SDMA) pendant le traitement (mais les niveaux de base avant le traitement n'ont pas été mesurés) qui ont diminué après l'arrêt du Mutian. Ce chat a également reçu une supplémentation en SAMe aux côtés de Mutian pour protéger le foie.
Mutian a été utilisé pour éliminer l'excrétion de FCoV chez les chats, et de plus amples détails à ce sujet peuvent être trouvés ci-dessous dans la section "Élimination de l'excrétion de FCoV".
Autres considérations pour l'utilisation d'inhibiteurs de protéase et d'analogues nucléosidiques
L'efficacité chez les chats atteints de PIF naturelle semble plus grande avec GS-441524 (Pedersen et al., 2019 ; Dickinson et al., 2020) qu'avec GC376 (Pedersen et al., 2018), car seuls six des 20 chats traités avec GC376 restent en rémission (Pedersen, données non publiées, 2018 ; cité dans Pedersen et al., 2019) contre 25 des 31 chats traités avec le GS-441524 (Pedersen et al., 2019), et trois des quatre chats présentant des signes neurologiques et oculaires traités avec la dose la plus élevée de GS-441524 sont également entrés en rémission (Dickinson et al., 2020). Les rechutes de la maladie ne répondant pas au retraitement étaient beaucoup plus fréquentes avec le GC376 qu'avec le GS-441524, et la plupart des rechutes observées dans l'essai GC376 étaient de nature neurologique, contrairement à l'essai GS-441524. Les deux traitements ont provoqué des réactions similaires au site d'injection et semblaient relativement sûrs, bien que GC376 interfère avec le développement des dents permanentes lorsqu'il est administré à des chatons plus jeunes. Bien que les résultats des études de terrain semblent favoriser le traitement au GS-441524, une partie de la différence pourrait avoir été influencée par la façon dont les deux médicaments ont été administrés, car l'efficacité du GC376 aurait pu être meilleure si les 20 chats avaient été traités sans interruption pendant 12 jours. semaines, plutôt qu'avec des périodes progressivement plus longues commençant à seulement deux semaines au début de l'essai chez les cinq premiers chats. Cela a été fait parce que les 10 chats infectés expérimentalement traités avec le GS-441524 (Murphy et al., 2018) n'ont également reçu initialement qu'un traitement de deux semaines, bien que deux chats aient eu besoin d'un deuxième traitement. Ainsi, un autre essai de traitement sur le terrain avec GC376 serait justifié en utilisant un traitement plus long avec une dose plus élevée et un plus grand nombre de chats avant qu'une comparaison finale puisse être faite. Il serait également important d'évaluer les deux types de médicaments en combinaison. Ni le GC376 ni le GS-441524 ne sont actuellement disponibles dans le commerce ni autorisés pour une utilisation chez les animaux, bien que les propriétaires s'approvisionnent en agents via Internet et administrent eux-mêmes ces agents. Les vétérinaires dont les clients utilisent ces médicaments pourraient avoir besoin de contacter leurs organismes de réglementation professionnels pour obtenir des conseils sur leur position juridique face à de tels cas. La fourniture de soins de soutien aux chats sous traitement et à leurs propriétaires dans ces circonstances est généralement recommandée. Ni le GC376 ni le GS-441524 ne sont actuellement disponibles dans le commerce ni autorisés pour une utilisation chez les animaux, bien que les propriétaires s'approvisionnent en agents via Internet et administrent eux-mêmes ces agents. Les vétérinaires dont les clients utilisent ces médicaments pourraient avoir besoin de contacter leurs organismes de réglementation professionnels pour obtenir des conseils sur leur position juridique face à de tels cas. La fourniture de soins de soutien aux chats sous traitement et à leurs propriétaires dans ces circonstances est généralement recommandée. Ni le GC376 ni le GS-441524 ne sont actuellement disponibles dans le commerce ni autorisés pour une utilisation chez les animaux, bien que les propriétaires s'approvisionnent en agents via Internet et administrent eux-mêmes ces agents. Les vétérinaires dont les clients utilisent ces médicaments pourraient avoir besoin de contacter leurs organismes de réglementation professionnels pour obtenir des conseils sur leur position juridique face à de tels cas. La fourniture de soins de soutien aux chats sous traitement et à leurs propriétaires dans ces circonstances est généralement recommandée.
La résistance aux médicaments est relativement courante pour les agents antiviraux, en particulier avec une exposition prolongée aux médicaments, des taux de mutation virale élevés et parfois la génétique peut jouer un rôle. Dans l'étude de traitement GC376 (Pedersen et al., 2018), les séquences du gène de la protéase de type 3C d'un certain nombre de chats ont été comparées entre le moment de la présentation et après le traitement GC376 dans des échantillons obtenus à l'autopsie.examen après euthanasie pour persistance ou rechute de PIF ; un seul chat a montré un changement dans la séquence de son gène de protéase de type 3C. Ce chat avait présenté une rechute avec un épanchement causé par la PIF 30 semaines après le début du traitement (qui comprenait deux cycles de traitement totalisant 16 semaines). Les trois modifications/mutations génétiques trouvées chez ce chat ont ensuite été étudiées pour la résistance au GC376 (Perera et al., 2019) ; une seule des mutations a conféré un changement, une petite réduction, de la sensibilité à GC376. Dans l'étude évaluant le traitement au GS-441524 (Pedersen et al., 2019), un seul chat de cette étude aurait montré des signes de résistance aux médicaments, bien qu'aucune étude de séquençage n'ait été réalisée. Ainsi, la résistance aux médicaments ne semble pas être courante. Il a été suggéré lors d'une conférence FIP que seul un petit pourcentage de chats (~ 3%) étaient résistants au GS-441524 (Pedersen N, communication personnelle). Cependant, la résistance est une menace réelle et la résistance au GS-5734 (Remdesivir), qui est maintenant utilisé chez l'homme, a été associée à des mutations d'acides aminés dans l'ARN polymérase et à la relecture de l'exonucléase dans les coronavirus propagés par culture tissulaire (Agostini et al., 2018 ). Ainsi, il peut être important d'évaluer différents types de médicaments antiviraux (par exemple GC376, GS-441524) en combinaison, comme cela a été fait pour l'infection par le VIH et l'hépatite C chez l'homme (Pedersen et al., 2019). Les inquiétudes concernant la résistance aux antiviraux sont à l'origine de la réticence à utiliser des antiviraux chez les chats sains infectés par le FCoV, comme décrit ci-dessous dans la section « Élimination de l'excrétion du FCoV ». a été associée à des mutations d'acides aminés dans l'ARN polymérase et l'exonucléase de relecture dans les coronavirus propagés par culture tissulaire (Agostini et al., 2018). Ainsi, il peut être important d'évaluer différents types de médicaments antiviraux (par exemple GC376, GS-441524) en combinaison, comme cela a été fait pour l'infection par le VIH et l'hépatite C chez l'homme (Pedersen et al., 2019). Les inquiétudes concernant la résistance aux antiviraux sont à l'origine de la réticence à utiliser des antiviraux chez les chats sains infectés par le FCoV, comme décrit ci-dessous dans la section « Élimination de l'excrétion du FCoV ». a été associée à des mutations d'acides aminés dans l'ARN polymérase et l'exonucléase de relecture dans les coronavirus propagés par culture tissulaire (Agostini et al., 2018). Ainsi, il peut être important d'évaluer différents types de médicaments antiviraux (par exemple GC376, GS-441524) en combinaison, comme cela a été fait pour l'infection par le VIH et l'hépatite C chez l'homme (Pedersen et al., 2019). Les inquiétudes concernant la résistance aux antiviraux sont à l'origine de la réticence à utiliser des antiviraux chez les chats sains infectés par le FCoV, comme décrit ci-dessous dans la section « Élimination de l'excrétion du FCoV ».
Remdesivir
Le remdesivir, GS-5734, un promédicament du GS-441524, a été suggéré comme traitement des maladies respiratoires à coronavirus chez l'homme, notamment avec le COVID-19 dû au SRAS-CoV-2 (Beigel et al., 2020 ; Williamson et al ., 2020) et a été envisagé pour le traitement des coronavirus chez les chats (Izes et al., 2020c). Cependant, une grande étude n'a pas réussi à montrer l'efficacité du remdesivir dans le COVID-19 humain (Dyer, 2020). Le remdesivir est modifié par les cellules infectées pour donner l'ingrédient actif GS-441524. L'innocuité et l'efficacité du remdesivir pour la PIF chez les chats n'ont pas été établies (Pedersen, 2020b), bien que des preuves anecdotiques tirées de descriptions de cas sur le terrain suggèrent que le remdesivir injectable est efficace pour le traitement de la PIF (Spanner, 2020).
Médicaments immunomodulateurs
Les immunomodulateurs sont également couramment utilisés chez les chats atteints de PIF. L'idée derrière le traitement immunomodulateur est que ces produits pourraient stimuler la réponse immunitaire vers une réponse à médiation cellulaire ou pour réduire une réponse Th2 hyperactive. Un déséquilibre des lymphocytes T par rapport àIl a été suggéré que la réponse des lymphocytes B soit attribuée au développement de la PIF ; cependant, cette hypothèse a été remise en question (Pedersen et al., 2014). Une stimulation non spécifique du système immunitaire pourrait même être contre-indiquée, puisque les signes cliniques se développent et progressent en raison d'une réponse à médiation immunitaire. Par conséquent, le traitement avec ces médicaments n'est pas recommandé tant qu'il y a un manque d'efficacité documentée dans des études bien contrôlées (Hartmann et Ritz, 2008 ; Hartmann, 2018). Certains rapports de cas anciens suggèrent un certain effet par le biais d'un traitement immunomodulateur, tel que la tylosine, la promoduline, l'acémannane ou des « inducteurs de la para-immunité », mais la PIF n'a pas été confirmée dans ces études (Colgrove et Parker, 1971 ; Robison et al., 1971 ; Ford , 1986 ; Bolcskei et Bilkei, 1995a, 1995b ; Hartmann et Ritz, 2008).
L'immunostimulant polyprényl est un médicament qui s'est révélé prometteur pour l'immunomodulation. L'IPP est un agent oral disponible dans le commerce qui est administré trois fois par semaine et qui est considéré comme agissant en régulant à la hausse les cytokines Th-1. Dans une série de cas de trois chats atteints de PIF sans épanchement (confirmé par histopathologie chez un des trois chats uniquement), l'IPP était associée à une survie prolongée (Legendre et Bartges, 2009). Dans une étude de terrain, le traitement par IPP a été évalué chez 60 chats suspectés d'avoir une PIF sans épanchement par des vétérinaires de soins primaires et spécialisés, mais encore une fois, la confirmation de la PIF n'a pas été établie chez tous les chats et aucun témoin non traité n'a été inclus (Legendre et al. , 2017). Sur les 60 chats traités, 16 ont survécu plus de 100 jours ; parmi ceux-ci, huit ont survécu plus de 200 jours, dont quatre qui ont survécu plus de 300 jours. Les vétérinaires des chats traités qui ont survécu plus de 30 jours ont signalé des améliorations des signes cliniques et du comportement. Les temps de survie étaient significativement plus longs chez les chats qui n'avaient pas été traités simultanément avec des glucocorticoïdes systémiques, bien que les glucocorticoïdes ophtalmiques topiques n'aient pas affecté la survie (Legendre et al., 2017). Ainsi, l'utilisation d'IPP pourrait être prometteuse pour le traitement des chats atteints de PIF sans épanchement, bien que le nombre de chats répondant au traitement dans cette étude ait été globalement faible et que la PIF n'ait pas toujours été confirmée. Des études contrôlées chez des chats atteints de PIF confirmée seraient nécessaires pour évaluer l'efficacité. bien que les glucocorticoïdes ophtalmiques topiques n'affectent pas la survie (Legendre et al., 2017). Ainsi, l'utilisation d'IPP pourrait être prometteuse pour le traitement des chats atteints de PIF sans épanchement, bien que le nombre de chats répondant au traitement dans cette étude ait été globalement faible et que la PIF n'ait pas toujours été confirmée. Des études contrôlées chez des chats atteints de PIF confirmée seraient nécessaires pour évaluer l'efficacité. bien que les glucocorticoïdes ophtalmiques topiques n'affectent pas la survie (Legendre et al., 2017). Ainsi, l'utilisation d'IPP pourrait être prometteuse pour le traitement des chats atteints de PIF sans épanchement, bien que le nombre de chats répondant au traitement dans cette étude ait été globalement faible et que la PIF n'ait pas toujours été confirmée. Des études contrôlées chez des chats atteints de PIF confirmée seraient nécessaires pour évaluer l'efficacité.
Vaccination
Efficacité des vaccins PIF
À l'heure actuelle, il existe un vaccin intranasal disponible dans le commerce aux États-Unis et dans certains pays européens. Il contient un mutant sensible à la température de la souche DF2 FCoV de type II ; les coronavirus de type I sont cependant plus répandus sur le terrain dans la plupart des pays (Addie et Jarrett, 2001 ; Addie et al., 2003 ; Kummrow et al., 2005). Le vaccin vise à induire des réponses immunitaires muqueuses locales par l'induction d'IgA et d'immunité à médiation cellulaire. Cependant, il induit également le développement d'anticorps systémiques contre le FCoV, bien que généralement avec des titres faibles. L'efficacité de ce vaccin est remise en question. Les résultats des études expérimentales ont été incohérents, avec des fractions évitables comprises entre 0 et 75 % (Gerber et al., 1990 ; Hoskins et al., 1995a ; Hoskins et al., 1995b, McArdle et al., 1995 ; Gerber et al., 1995 ; Scott et al., 1995a, Scott et al., 1995b). Les résultats des études sur le terrain ont également été incohérents (Fehr et al., 1995, 1997 ; Postorino Reeves, 1995). Aucune différence dans le développement de la PIF entre les groupes vaccinés et placebo n'a été trouvée au cours des 150 premiers jours après la vaccination lorsque le vaccin a été utilisé dans des colonies de reproduction persanes (Fehr et al., 1995). Cependant, après 150 jours, significativement moins de cas de PIF sont survenus chez les chats vaccinés par rapport au groupe placebo (Fehr et al., 1995) et rétrospectivement, le virus a été trouvé dans les échantillons de sang des chats qui ont développé la PIF. Dans un autre essai, une fraction évitable de 75 % a été trouvée lorsque le vaccin a été testé dans un grand refuge pour chats aux États-Unis (Postorino Reeves, 1995), bien que la description de l'étude publiée soit très courte, ce qui rend difficile l'interprétation complète de l'étude. Dans cette étude, tous les chatons étaient négatifs pour les anticorps avant la vaccination. La conclusion est que le vaccin n'est probablement pas efficace chez les chats positifs aux anticorps qui ont déjà été exposés au FCoV. L'ADE de l'infection qui était une caractéristique de certains essais de vaccins expérimentaux (McArdle et al., 1995; Scott et al., 1995a; Scott et al., 1995b) , où plus de chats vaccinés que de témoins ont développé la PIF, n'a pas été observé dans études de terrain, suggérant que le vaccin peut être considéré comme sûr (Postorino Reeves, 1995; Fehr et al., 1995, 1997).
Utilisation du vaccin PIF
L'ABCD considère que le vaccin FIP n'est pas essentiel. Il ne peut pas être utilisé chez les chats positifs aux anticorps FCoV, ce qui limite considérablement son utilisation car de nombreux chats sont positifs aux anticorps FCoV. Les chatons FCoV négatifs pour les anticorps pourraient potentiellement bénéficier de la vaccination, en particulier s'ils pénètrent par la suite dans un environnement FCoV endémique et seraient donc à risque de développer une PIF. Le fait que dans les environnements multi-chats la plupart des chatons soient déjà infectés à l'âge de 16 semaines limite encore l'utilité du vaccin (Addie et Jarrett, 1992 ; Lutz et al., 2002 ; Pedersen et al., 2008).
Primo-vaccination
Si la vaccination doit être administrée, la 1 ère dose ne doit pas être administrée avant l'âge de 16 semaines, la 2 ème dose étant administrée trois semaines après la 1 ère dose.
Vaccinations de rappel
Si une primo-vaccination a été réalisée, des rappels annuels peuvent être envisagés. Bien que les études sur la durée de l'immunité fassent défaut, on pense qu'elle est de courte durée (Addie et al., 2003).
Contrôle du FCoV et du FIP dans des situations spécifiques
La PIF est particulièrement un problème de chats gardés en grands groupes, en particulier dans les chatteries d'élevage et les situations de sauvetage. Les chatteries d'élevage sont des environnements à haut risque pour la PIF. En Europe, il est probable que la grande majorité des chatteries d'élevage aient une infection endémique au FCoV (Felten et al., 2020). Très rarement, un nombre anormalement élevé de chats (> 10 % ; Barker et al., 2013) développent une PIF dans un environnement multi-chats. De telles « mini-épidémies » (appelées épizooties) sont très occasionnellement signalées (Graham et al., 2012 ; Wang et al., 2013 ; Barker et al., 2013) et d'autres ont été observées par les auteurs de ces lignes directrices ( données non publiées). Plusieurs facteurs pourraient contribuer à ces « mini-épidémies ». Ces facteurs incluent le FCoV qui a de fortes chances de devenir un FCoV associé à la FIP (il faut donc un faible nombre de mutations pour devenir associé à la FIP),
Approche générale du contrôle FCoV et FIP
Réduction de la transmission du FCoV
Étant donné que le FCoV se transmet principalement par voie féco-orale, l'hygiène est le pilier du contrôle de la PIF dans tout environnement multi-chats. L'infection au FCoV est maintenue dans un ménage par des cycles continus d'infection et de réinfection (Addie et al., 2003 ; Foley et al., 2003), la source d'infection étant les matières fécales dans le bac à litière. La PIF est rarement un problème chez les chats menant une vie d'intérieur et d'extérieur ou chez les chats errants qui enterrent leurs excréments à l'extérieur, à moins que ces chats ne proviennent d'environnements multi-chats (Riemer et al., 2016).
L'objectif de chaque foyer félin doit être de réduire la pression d'infection au FCoV et le risque de transmission. Ceci peut être réalisé en ne gardant pas plus de trois chats bien adaptés par pièce (et en gardant ces groupes de chats stables), en observant une hygiène stricte et en fournissant un accès extérieur si possible. Si l'accès extérieur n'est pas possible, il faut prévoir suffisamment de bacs à litière (un de plus que le nombre de chats). Les bacs à litière doivent être placés dans des pièces différentes, loin des bols de nourriture et d'eau. Ils doivent être débarrassés de leurs excréments au moins deux fois par jour et les ustensiles du bac à litière doivent être nettoyés quotidiennement. Les bacs à litière doivent être complètement vidés au moins une fois par semaine et nettoyés avec un détergent. Une étude (Addie et al., 2020a) ont suggéré qu'une litière terrestre de Fuller dont le suivi était minimal était associée à une charge virale réduite dans un foyer multi-chats par rapport à une autre litière terrestre de Fuller ; on pensait que cet effet était dû à un effet de liaison de l'argile dans la terre de Fuller ainsi qu'à la propriété de non-suivi de la litière pour aider à réduire la propagation. D'autres études plus importantes sont nécessaires. Bien que le FCoV ne soit que rarement libéré dans la salive, les bols de nourriture et d'eau doivent être nettoyés quotidiennement avec un détergent ou dans un lave-vaisselle à un cycle d'au moins 60°C, en raison du risque de contamination par fomite.
Gestion des excréteurs de FCoV
Dans certaines chatteries d'élevage, des tentatives pour au moins contrôler la propagation du FCoV par la ségrégation des chats ont été faites. L'excrétion fécale chez les chats se produit sur plusieurs mois ou parfois tout au long de la vie, en particulier dans les foyers multi-chats (Addie et Jarrett, 2001 ; Addie et al., 2003 ; Pedersen et al., 2008). L'identification des chats qui excrétent constamment une charge FCoV élevée et leur séparation des chats à faible excrétion et des chats fécaux RT-PCR négatifs ont été suggérées pour réduire les taux de transmission (Addie et Jarrett, 1995; Kass et Dent, 1995). Les délesteurs de charge FCoV élevés persistants peuvent être détectés à l'aide de la RT-PCR quantitative sur des échantillons fécaux ou des écouvillons rectaux, qui peuvent être collectés par le propriétaire du chat. Une RT-PCR individuelle répétée de quatre échantillons fécaux ou écouvillons prélevés à une semaine d'intervalle a été recommandée pour identifier correctement les non-excréteurs. La fréquence et l'intervalle recommandés de collecte d'échantillons fécaux pour l'identification des chats excrétant dans les ménages multichats par RT-PCR ont été suggérés comme au moins trois échantillons fécaux collectés à des intervalles d'une semaine à un mois (Klein-Richers et al., 2020 ). L'utilisation du test d'anticorps FCoV sur des échantillons de sang à un moment donné, au lieu d'un échantillonnage fécal répété pour la RT-qPCR, pour identifier les excréteurs de FCoV ne s'est pas avérée utile dans une autre étude (Felten et al., 2020), malgré la découverte d'une corrélation positive entre les titres d'anticorps et la probabilité et la fréquence de l'excrétion fécale de FCoV et de la charge virale (Felten et al., 2020). En effet, malgré cette corrélation,
Le laboratoire effectuant la RT-PCR à partir d'écouvillons fécaux doit fournir les charges de FCoV et/ou une interprétation des résultats indiquant si un chat est considéré ou non comme un délesteur de charge FCoV élevé et persistant. Lorsque des délesteurs persistants de charges élevées sont identifiés dans un environnement multi-chats, l'accès à leurs bacs à litière par des non-délesteurs doit être strictement évité. Idéalement, trois catégories de chats sont formées pour se séparer les unes des autres : les gros perdants persistants, les faibles perdants et les non-perdants. Cependant, si ce n'est pas faisable et pour des raisons pratiques, il peut être recommandé au moins de séparer les gros excréteurs des faibles/non excréteurs. De plus, les recommandations sur la façon de réduire la pression d'infection au FCoV énumérées ci-dessus doivent être strictement appliquées, et les chats infectés par le FCoV ne doivent pas être exposés à des situations stressantes. Le dépistage des délesteurs de charge FCoV élevés persistants donne une image temporaire et les résultats peuvent changer avec le temps. Les chats peuvent être retestés six à neuf mois plus tard pour évaluer si la situation a changé.
Élimination de l'excrétion du FCoV
Une étude publiée (Addie et al., 2020c) a décrit l'utilisation d'un nouvel analogue nucléosidique oral 'Mutian X' (le constituant est en instance de brevet [2020] donc l'identité de l'agent n'est pas disponible bien qu'il soit suggéré d'être GS-441524 ( Pedersen, 2020a)) pour éliminer l'excrétion de FCoV (identifiée par RT-qPCR fécale) chez 29 chats dans quatre ménages avec une infection endémique. Une deuxième étude décrit également l'utilisation du « Mutian » oral pour éliminer l'infection au FCoV chez quatre chats d'un ménage qui vivait avec un chat qui a été traité avec succès pour la PIF avec du Mutian oral (Addie et al., 2020b). Ces deux études décrivent des ménages dans lesquels les propriétaires souhaitaient éliminer l'excrétion de FCoV en raison de cas antérieurs de PIF dans leur ménage, y compris pour empêcher la réinfection d'un chat guéri par la PIF par d'autres chats. Dans les deux études, une cure de 4 jours de 4 mg/kg par voie orale q 24 h a été efficace pour éliminer l'excrétion de FCoV ; les périodes de suivi pour confirmer la durée d'élimination étaient variables dans les études. Dans l'étude plus large (Addie et al., 2020c), deux chats qui ont terminé l'étude dans un ménage de quatre chats étaient toujours négatifs 155 et 157 jours après l'arrêt de Mutian X, tandis que les autres chats d'autres ménages qui avaient des périodes de suivi étaient négatif entre trois et 51 jours après l'arrêt de Mutian X. L'étude n'était pas contrôlée par placebo, de sorte que l'élimination spontanée du FCoV par les chats traités ne peut être exclue, mais la chute brutale de l'excrétion de FCoV observée au début du traitement par Mutian X était cohérente avec l'effet étant dû au traitement. La raison d'être de l'utilisation de Mutian X pour éliminer l'excrétion de FCoV est d'établir des ménages exempts de FCoV pour éliminer le risque de PIF. Un problème potentiel avec cette approche, cependant, est que parce que le FCoV est si courant dans les populations de chats et peut être transporté par des fomites, il est probablement difficile de maintenir un statut FCoV négatif à long terme et il est très peu probable que le traitement conduise à une immunité plus permanente que l'infection naturelle (Pedersen, 2020a ; Pedersen, 2021a). De plus, il est à noter que beaucoup conseillent de ne conserver l'utilisation d'antiviraux que pour le traitement des chats atteints de PIF, compte tenu du potentiel de développement d'une résistance (Pedersen, 2021a), et même si Mutian X n'est pas homologué pour traitement de la PIF, il est connu pour être l'un des agents utilisés pour traiter la maladie sur le terrain (Pedersen, 2020a).
Chatteries d'élevage
Les chatteries d'élevage sont les ménages dans lesquels la réduction de la pression d'infection par le FCoV revêt une importance particulière. Une étude de 37 chatteries d'élevage en Allemagne, qui a effectué une RT-PCR sur des échantillons fécaux prélevés sur des chats dans les chatteries, n'en a trouvé aucun exempt de FCoV (Klein-Richers et al., 2020), montrant à quel point le FCoV est très répandu dans de tels environnements. Dans cette étude, dans laquelle tous les ménages avaient ≥ 5 chats, le fait d'avoir uniquement des chats de < 1 an était associé à un risque accru d'excrétion de FCoV ; les mesures de gestion et d'élevage (par exemple, minutie du nettoyage, nombre de bacs à litière, fréquence de nettoyage et de désinfection) n'étaient pas associées à la prévalence de l'excrétion fécale (Klein-Richers et al., 2020). Des mesures particulières chez les chatons peuvent être envisagées. La PIF survient généralement après que les chatons ont quitté l'éleveur et sont dans un nouveau foyer (Cave et al., 2002). Il a été suggéré que la plupart des chatons sont considérés comme protégés contre l'infection par le FCoV par des anticorps d'origine maternelle (MDA) jusqu'à l'âge de cinq à six semaines. Dans certaines études, la transmission du FCoV a été évitée en isolant les reines gestantes deux semaines avant la naissance, puis en déplaçant leurs chatons dans un environnement propre, à l'écart des autres chats lorsqu'ils ont cinq à six semaines, et en les y maintenant jusqu'à ce qu'ils aillent dans une nouvelle maison. (Addie et Jarrett, 1992, 1995). Pour que cette méthode réussisse, l'éleveur est tenu de suivre des méthodes strictes d'hygiène de quarantaine. Cependant, la procédure a échoué dans une autre étude dans laquelle il a été constaté que des chatons excrétaient le FCoV dès l'âge de deux semaines (Lutz et al., 2002), remise en cause de la protection par MDA. De plus, les comportementalistes vétérinaires spécialisés déconseillent souvent le sevrage précoce en raison d'un risque de problèmes de socialisation chez ces chatons (Philip et Seitz, 1959 ; Guyot et al., 1980 ; Bateson, 1981).
Il existe des tests PCR disponibles dans le commerce qui visent à détecter les chats résistants à la PIF (discutés brièvement dans la section ci-dessus sur la pathogenèse et l'immunité). Ces tests ne sont actuellement pas recommandés comme base pour les décisions d'élevage. Il a été démontré que l'élevage sélectif positif pour la « résistance à la PIF » dans une colonie de chats de laboratoire diminue la survie de la progéniture après une infection intrapéritonéale par le FCoV associé à la FIP (Pedersen et al., 2016). La diminution de la résistance à la PIF chez ces chats était associée à une diminution de l'hétérozygotie génomique.
Installations de secours, abris et pensions pour chats
Prévenir l'infection par le FCoV dans les centres de secours, les refuges et les pensions pour chats est extrêmement difficile. Dans les chatteries et refuges de plus de six chats, l'infection au FCoV est pratiquement toujours présente (Pedersen, 2009). Les chats entrants doivent être maintenus en quarantaine pendant au moins trois semaines. Après l'entrée dans un refuge, l'excrétion du FCoV augmente considérablement en une semaine chez les chats qui étaient déjà infectés à l'entrée, et plus de la moitié des chats initialement négatifs excrétaient le FCoV une semaine plus tard (Pedersen et al., 2004). Des précautions d'hygiène strictes, comme le contrôle des mouvements, les protocoles d'hygiène pour les soignants, le nettoyage et la désinfection, doivent être appliquées pour réduire la contamination virale et la propagation virale. Une attention particulière doit être accordée à la stérilisation des bacs à litière entre les utilisations chez différents chats, en ayant des bacs à litière et des pelles dédiés à chaque enclos pour chat, et éviter la transmission de fomites sur les ustensiles de nettoyage tels que les brosses. Idéalement, les chats devraient être gardés en petits groupes de trois chats ou moins par pièce (Addie et al., 2009) (voir ci-dessus) et avec un échange limité d'animaux. La réduction du stress est d'une importance particulière, car le stress peut entraîner une augmentation de la production de virus et un risque de développement de la PIF. Les nouvelles chatteries devraient être conçues avec le contrôle des maladies infectieuses et la réduction du stress comme priorités (Möstl et al., 2013 ; Wagner et al., 2018a, 2018b). Plus d'informations sur le contrôle des maladies infectieuses dans les refuges peuvent être trouvées dans les directives ABCD sur car le stress peut entraîner une augmentation de la production de virus et un risque de développement de la PIF. Les nouvelles chatteries devraient être conçues avec le contrôle des maladies infectieuses et la réduction du stress comme priorités (Möstl et al., 2013 ; Wagner et al., 2018a, 2018b). Plus d'informations sur le contrôle des maladies infectieuses dans les refuges peuvent être trouvées dans les directives ABCD sur car le stress peut entraîner une augmentation de la production de virus et un risque de développement de la PIF. Les nouvelles chatteries devraient être conçues avec le contrôle des maladies infectieuses et la réduction du stress comme priorités (Möstl et al., 2013 ; Wagner et al., 2018a, 2018b). Plus d'informations sur le contrôle des maladies infectieuses dans les refuges peuvent être trouvées dans les directives ABCD surLes maladies infectieuses en situation d'hébergement et leur prise en charge .
Prise en charge des chats infectés par le FCoV apparemment en bonne santé
Un vaccin contre la PIF n'est pas utile chez les chats infectés par le FCoV. La question a été soulevée de savoir si les chats infectés par le FCoV devraient recevoir d'autres vaccins, puisque la vaccination a été identifiée comme un facteur de stress précédant l'apparition de la PIF dans une étude (Riemer et al., 2016). Cependant, les études manquent pour soutenir que les chats infectés par le FCoV devraient être vaccinés moins souvent que les chats non infectés. Par conséquent, jusqu'à preuve du contraire, les chats positifs au FCoV en bonne santé devraient être vaccinés de la même manière que les chats non infectés.
Tout traitement induisant une immunosuppression pourrait augmenter le risque de développement de la PIF chez les chats infectés par le FCoV (Addie et al., 2015). Cependant, les chats peuvent avoir des maladies qui nécessitent un traitement immunosuppresseur en présence d'une infection au FCoV.
Maintenir un statut FCoV négatif
Une fois qu'un ménage ou une zone géographique a atteint un statut FCoV négatif, tous les efforts doivent être faits pour le maintenir exempt de FCoV. Des prélèvements rectaux pour RT-PCR, effectués quatre fois, à une semaine d'intervalle, et un test d'anticorps sériques ou plasmatiques peuvent aider à prévenir l'introduction de chats infectés dans une maison ou une zone géographique exempte de FCoV (Addie et al., 2012). Les vétérinaires des îles Falkland (Malvinas) ont institué une politique selon laquelle seuls les chats séronégatifs au FCoV pouvaient être importés dans les îles, protégeant les chats des îles de la PIF en empêchant l'introduction du FCoV (Addie et al., 2012). Cependant, comme indiqué ci-dessus dans la section « Mesures de réduction de la pression d'infection par le FCoV et du risque de transmission du FCoV dans les environnements multi-chats »,
COORDONEES :
Adresse postale :
Mme Ganka KRASTEVA
4 CHEMIN DES TROIS CORNES
61500, NEAUPHE SOUS ESSAI
FRANCE
Téléphone fixe : 02.33.29.47.68
Merci de bien vouloir respecter ma vie professionnelle et privée en me contactant par téléphone uniquement dans les plages horaires suivantes :
lundi : 19 h 00 - 20 h 00
mardi : 19 h 00 - 20 h 00
mercredi : 19 h 00 - 20 h 00
jeudi : 14 h 00 - 20 h 00
vendredi : 19 h 00 - 20 h 00
samedi : 10 h 00 - 20 h 00
dimanche : FERME
Suivez nous sur :
Contactez-nous par mail :
N° SIRET 793 066 838 00020
Elevage déclaré auprès de la Chambre de Commerce et de l’Agriculture , de la DDETSPP et de la MSA de l'Orne (2017) et inscrit dans la Base Nationale des Opérateurs (2024)


Membre du Be A British Cat
(Club de race affilié au LOOF et à la FFF qui applique les règlements de la FIFé)
COORDONEES BANCAIRES:
IBAN: FR76 1660 6000 7084 8434 0632 666
Code BIC : AGRIFRPP866
Intitulé : Mme Ganka KRASTEVA
LIVRE D'OR (les avis des clients)
C'est votre moyen de me faire connaitre vos impressions sur l'élevage.
Ce n'est pas de formulaire de contact ni d'inscription sur la liste d'attente.
Merci.

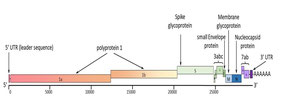
















VANOVERSCHELDE David (mardi, 29 août 2023 07:47)
Merci Ganka de nous avoir confié UMBRELLA qui est une minette merveilleuse de beauté, câline, calme, sociable, une vraie boite à ronrons et pot de colle. On l'adore.
Auger beatrice (vendredi, 30 décembre 2022 06:00)
Un grand merci pour l éducation de votre chatterie du bonheur. nana 4 ans 1/2 a su s adapter à nous rapidement et pris ces repères dans son nouvel environnement.
Amicalement.
vrecq nathalie (jeudi, 03 novembre 2022 20:23)
Bonsoir Madame,
je vous remercie d'avoir pris le temps de discuter et déchanger sur ce vaste sujet qui devrait en tant qu'éleveur tous nous sentir concerner !
Si vous aviez le lien internet où je pourrais trouver le produit et les probiotiques dont on a parlé je vous remercie d'avance de votre aide
Je suis heureuse d'être tombée sur votre site et d'avoir pu échanger !
Grand merci d'avance
Vrecq Nathalie (chatterie Des Jardins Persans)
Isabel Touchet (mardi, 06 avril 2021 19:29)
Razmoket est tellement gentil et affectueux. Il a été bien élevé par sa maman Nymphette.
Merci Ganka.
Donzé Aurélia (samedi, 09 novembre 2019 13:49)
Quel bonheur d avoir pu accueillir Orchidée dans notre foyer. Du pur BONHEUR
une minette adorable, et superbe
Merci Ganka Krasteva pour votre confiance
Chaleureusement
Aurélia
Xie Frédéric (samedi, 27 juillet 2019 17:41)
Grand merci à l'accueil que nous avons reçu ! Je salue tout le travail fait par Mme Krasteva ! Et ses chats sont vraiment magnifiques !
isabelle laplanche (dimanche, 07 février 2016 22:29)
Un grand merci pour l'accueil chaleureux qui nous a été réservé, pour ce temps que vous avez pris avant l'adoption pour répondre à toutes nos questions, pour ce moment partagé autour de Liona et pour cette magnifique princesse que vous nous avez confié. Nous avons notre British Bonheur et nos enfants sont aux anges combles de câlins et de ronrons. Des éleveurs de confiance, adorables et généreux. Merci encore.
Sylvie (dimanche, 13 décembre 2015 19:41)
Tellement ravis d'avoir accueilli chez nous notre petit Laurel ! Élevage merveilleux ! Merci